名校
解题方法
1 . 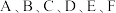 是前四周期的六种元素,原子序数依次增大。
是前四周期的六种元素,原子序数依次增大。 三种元素分别位于不同短周期的不同主族。
三种元素分别位于不同短周期的不同主族。 对应的简单离子核外电子排布相同,
对应的简单离子核外电子排布相同, 元素可形成一种新型漂白剂(结构如图),E元素正三价阳离子的
元素可形成一种新型漂白剂(结构如图),E元素正三价阳离子的 轨道为半充满状态,F元素最外层只有一个电子,焰色反应为蓝绿色。
轨道为半充满状态,F元素最外层只有一个电子,焰色反应为蓝绿色。

回答下列问题:
(1)基态A原子电子占据最高能级的电子云轮廓图为___________ 形。D元素基态原子核外M层电子的自旋状态___________ (填“相同”或“相反”)。基态原子与F同周期且最外层电子数相等的元素还有___________ (填元素符号)。E元素位于元素周期表___________ 区。
(2)B元素名称是________ 。新型漂白剂中C元素的化合价为_______ 。C元素能形成两种常见单质,其中沸点高的是_________ (填分子式)
(3)元素E与F的第二电离能
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
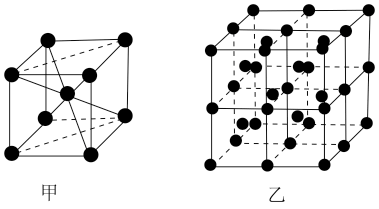
(4)E的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的截面图是_________(填字母序号)。
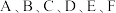 是前四周期的六种元素,原子序数依次增大。
是前四周期的六种元素,原子序数依次增大。 三种元素分别位于不同短周期的不同主族。
三种元素分别位于不同短周期的不同主族。 对应的简单离子核外电子排布相同,
对应的简单离子核外电子排布相同, 元素可形成一种新型漂白剂(结构如图),E元素正三价阳离子的
元素可形成一种新型漂白剂(结构如图),E元素正三价阳离子的 轨道为半充满状态,F元素最外层只有一个电子,焰色反应为蓝绿色。
轨道为半充满状态,F元素最外层只有一个电子,焰色反应为蓝绿色。
回答下列问题:
(1)基态A原子电子占据最高能级的电子云轮廓图为
(2)B元素名称是
(3)元素E与F的第二电离能

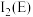 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)E的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的截面图是_________(填字母序号)。

A. | B.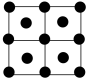 | C. | D.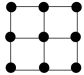 |
您最近一年使用:0次
解题方法
2 . H、N、O、S、Fe、Cu是日常生活中常见的元素。
(1)原子中电子有两种相反的自旋状态,分别用+ 和-
和- 表示,称为电子的自旋磁量子数,则Fe2+中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则Fe2+中电子自旋磁量子数的代数和为___________ ,Fe3+有___________ 种能量不同的电子。
(2)[Cu(NH3)4]SO4·H2O中,Cu2+的配位数为___________ , [Cu(NH3)4]2+的空间构形是平面正方形,则Cu2+的杂化方式可能是___________ 。
A. sp B.sp2 C. sp3 D. dsp2
(3)硼酸晶体是片层结构如图所示,其中键角∠B-O-H(114°)。则硼酸晶体中氧原子的杂化方式是___________ 。键角∠B-O- H不同于键角∠O- B-O的原因是___________ 。

(4)GaN (相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为a cm。

沿Z轴从上往下俯视的晶胞投影图如下图所示。

①若图中原子1的分数坐标是( ,
, ,
, ), 则原子2的分数坐标是(
), 则原子2的分数坐标是(___________ ,___________ ,___________ )。
②晶胞结构中原子1、5之间的距离为___________ cm。
③设阿伏加德罗常数的值为NA,则GaN晶体的密度为___________ g·cm-3
(1)原子中电子有两种相反的自旋状态,分别用+
 和-
和- 表示,称为电子的自旋磁量子数,则Fe2+中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则Fe2+中电子自旋磁量子数的代数和为(2)[Cu(NH3)4]SO4·H2O中,Cu2+的配位数为
A. sp B.sp2 C. sp3 D. dsp2
(3)硼酸晶体是片层结构如图所示,其中键角∠B-O-H(114°)。则硼酸晶体中氧原子的杂化方式是

(4)GaN (相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为a cm。

沿Z轴从上往下俯视的晶胞投影图如下图所示。

①若图中原子1的分数坐标是(
 ,
, ,
, ), 则原子2的分数坐标是(
), 则原子2的分数坐标是(②晶胞结构中原子1、5之间的距离为
③设阿伏加德罗常数的值为NA,则GaN晶体的密度为
您最近一年使用:0次
名校
解题方法
3 . 金属钛有“生物金属、海洋金属、太空金属”的美称。有些含钛的化合物在耐高温、环保或者抑菌方面有着重要的应用,钛元素也被称为“健康钛”。
(1)Ti元素位于元素周期表的_______ 区,基态原子电子排布式为_______ 。
(2)TiCl4与SiCl4互为等电子体。SiCl4可以与N-甲基咪唑
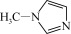
 发生反应。
发生反应。
①TiCl4分子的空间构型为_______ 。
②N-甲基咪唑分子中碳原子的杂化轨道类型为_______ ,C、N、Si的电负性由大到小的顺序为_______ ,1个 含有
含有_______ 个π键。
(3)TiCl4可以与胺形成配合物,如TiCl4(CH3NH2)2、TiCl4(H2NCH2CH2NH2)。
① TiCl4 (H2NCH2CH2NH2)中提供电子对形成配位键的原子是_______ 。
②乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性较差的是_______ (填“Mg2+”或“Cu2+”)。
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似(如图),其中阴离子(N3-)采用面心立方最密堆积方式,X-射线衍射实验测得氮化钛的晶胞参数(晶胞边长)为a pm,则r(N3-)为_______ pm。该氮化钛的密度为_______ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。

(1)Ti元素位于元素周期表的
(2)TiCl4与SiCl4互为等电子体。SiCl4可以与N-甲基咪唑


 发生反应。
发生反应。①TiCl4分子的空间构型为
②N-甲基咪唑分子中碳原子的杂化轨道类型为
 含有
含有(3)TiCl4可以与胺形成配合物,如TiCl4(CH3NH2)2、TiCl4(H2NCH2CH2NH2)。
① TiCl4 (H2NCH2CH2NH2)中提供电子对形成配位键的原子是
②乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性较差的是
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似(如图),其中阴离子(N3-)采用面心立方最密堆积方式,X-射线衍射实验测得氮化钛的晶胞参数(晶胞边长)为a pm,则r(N3-)为

您最近一年使用:0次
2021-11-18更新
|
907次组卷
|
7卷引用:山东省威海乳山市银滩高级中学2021-2022学年高二12月月考化学试题
山东省威海乳山市银滩高级中学2021-2022学年高二12月月考化学试题黑龙江省大庆市2022届高三上学期第一次教学质量检测化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】17江西省重点校2022-2023学年高三上学期第二次联考化学试题.(已下线)一轮巩固卷8-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)宁夏吴忠市2022届高三4月模拟联考(二模)理科综合化学试题黑龙江省大庆市2023-2024学年高三上学期第一次模拟考试化学试题
名校
解题方法
4 . 硅元素是现代信息技术中最重要的元素之一,回答下列问题。
(1)若将基态硅原子最高能级的电子排布图表示为 ,则它违背了
,则它违背了___________ 这一电子排布规律,X、Y与硅位于同周期,若X、Y的第一电离能(相对大小)中间只有Si,则X、Y分别是___________ 。
(2)以SiO2为基本原料制备粗硅的原理为 ,与CO互为等电子体的分子和离子分别为
,与CO互为等电子体的分子和离子分别为____________ ,使SiO2固体、CO液化需要克服的作用力分别是___________ 、___________ 。若Si-O键的键键能为a ,则使1mol SiO2全部变成Si、O原子至少需要提供的能量是
,则使1mol SiO2全部变成Si、O原子至少需要提供的能量是___________ kJ。SiO2、石墨两物质中,硅、碳原子杂化类型分别为___________ 。
(3)制备高纯度硅的过程中会有一系列中间产物如SiH3Cl、SiH2Cl2、SiHCl3、SiCl4等物质生成。上述中间产物中属中正四面体构型的是___________ ,沸点SiHCl3___________ SiCl4(填“>”或“<”)。
(4)晶体硅的晶胞如下,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。则图中原子①的原子坐标是___________ ,晶体中硅原子的空间利用率为___________ (用含π的式子表示)。

(1)若将基态硅原子最高能级的电子排布图表示为
 ,则它违背了
,则它违背了(2)以SiO2为基本原料制备粗硅的原理为
 ,与CO互为等电子体的分子和离子分别为
,与CO互为等电子体的分子和离子分别为 ,则使1mol SiO2全部变成Si、O原子至少需要提供的能量是
,则使1mol SiO2全部变成Si、O原子至少需要提供的能量是(3)制备高纯度硅的过程中会有一系列中间产物如SiH3Cl、SiH2Cl2、SiHCl3、SiCl4等物质生成。上述中间产物中属中正四面体构型的是
(4)晶体硅的晶胞如下,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。则图中原子①的原子坐标是

您最近一年使用:0次
2021-11-17更新
|
597次组卷
|
6卷引用:山东省威海乳山市银滩高级中学2021-2022学年高二12月月考化学试题
山东省威海乳山市银滩高级中学2021-2022学年高二12月月考化学试题河南省重点中学2021-2022学年高三上学期模拟调研(一)化学试题 (已下线)备战2022年高考化学精准检测卷【全国卷】15湖南省长沙市第一中学2021-2022学年高三下学期月考(七)化学试题湖南省株洲市攸县一中2022-2023学年高三第四次月考化学试题(已下线)一轮巩固卷5-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)
解题方法
5 . 光刻胶作为集成电路制作过程中的关键材料,它的技术水平直接决定了集成电路制作工艺的成败。感光剂Ⅰ与化合物Ⅱ在碱性条件下反应,生成化合物Ⅲ是某光刻胶工艺的一个环节。

D为
回答下列问题:
(1)基态氮原子的价电子轨道表达式为___________ 。
(2)物质Ⅱ中除H元素外,其它元素均位于元素周期表的___________ 区。
(3)NH3、CH4、H2S中键长最长的是___________ ,其分子空间结构为___________ 形。
(4)下列说法正确的是___________ (填选项字母)。
A.在Ⅰ中C原子全部采取sp2杂化
B.在Ⅱ中Cl元素的电负性最大
C.在Ⅱ的=N2基团中,存在配位键
D.在Ⅲ中硫氧键的键能均相等
E.在第二周期元素中,第一电离能(I1)比氮大的元素有3种
(5)光刻胶原理是利用反应前后,不同物质在刻蚀液中溶解性的差异,形成不同的图形。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是___________ ,原因是___________ 。
(6)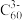 能与K+形成超分子加合物,如图所示,该晶胞中K+的数目为
能与K+形成超分子加合物,如图所示,该晶胞中K+的数目为___________ ,已知晶胞参数为acm,阿伏加德罗常数的值为NA,则该晶胞的密度为___________ g/cm3 (列出计算式即可)。


D为

回答下列问题:
(1)基态氮原子的价电子轨道表达式为
(2)物质Ⅱ中除H元素外,其它元素均位于元素周期表的
(3)NH3、CH4、H2S中键长最长的是
(4)下列说法正确的是
A.在Ⅰ中C原子全部采取sp2杂化
B.在Ⅱ中Cl元素的电负性最大
C.在Ⅱ的=N2基团中,存在配位键
D.在Ⅲ中硫氧键的键能均相等
E.在第二周期元素中,第一电离能(I1)比氮大的元素有3种
(5)光刻胶原理是利用反应前后,不同物质在刻蚀液中溶解性的差异,形成不同的图形。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是
(6)
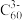 能与K+形成超分子加合物,如图所示,该晶胞中K+的数目为
能与K+形成超分子加合物,如图所示,该晶胞中K+的数目为
您最近一年使用:0次
2021-10-30更新
|
177次组卷
|
2卷引用:山东省威海乳山市银滩高级中学2021-2022学年高二12月月考化学试题
名校
解题方法
6 . 第Ⅷ族元素Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
(1)基态Ni原子核外能量最高的电子位于___________ 能级,同周期元素中,基态原子未成对电子数与Ni相同的元素有___________ 种。
(2)Fe3+与酚类物质的显色反应常用于其离子检验,已知Fe3+遇邻苯二酚( )和对苯二酚(
)和对苯二酚(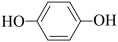 )均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是
)均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是___________ 。
(3)锂离子电池的正极材料大多采用橄榄石型的LiMPO4(M=Fe、Co等元素)。
①写出基态Fe原子的价电子排布图为___________ 。
②第四电离能I4(Co)比I4(Fe)小,原因是___________ 。
(4)右表为Co2+、Ni2+不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,Ni2+比较稳定的配离子配位数是___________ (填“4”或“6”)
(5)FeCO3可作补血剂,CoCO3可用于陶瓷工业的着色剂。已知:r(Fe2+)为61pm,r(Co2+)为65pm在隔绝空气条件下分别加热FeCO3和CoCO3时,FeCO3的分解温度低于CoCO3,其原因是___________ 。
(1)基态Ni原子核外能量最高的电子位于
(2)Fe3+与酚类物质的显色反应常用于其离子检验,已知Fe3+遇邻苯二酚(
 )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是
)均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是(3)锂离子电池的正极材料大多采用橄榄石型的LiMPO4(M=Fe、Co等元素)。
①写出基态Fe原子的价电子排布图为
②第四电离能I4(Co)比I4(Fe)小,原因是
(4)右表为Co2+、Ni2+不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,Ni2+比较稳定的配离子配位数是
| 离子 | 配位数 | 晶体场稳定化能(Dq) |
| Co2+ | 6 | -8Dq+2p |
| 4 | -5.34Dq+2p | |
| Ni2+ | 6 | -12Dq+3p |
| 4 | -3.56Dq+3p |
(5)FeCO3可作补血剂,CoCO3可用于陶瓷工业的着色剂。已知:r(Fe2+)为61pm,r(Co2+)为65pm在隔绝空气条件下分别加热FeCO3和CoCO3时,FeCO3的分解温度低于CoCO3,其原因是
您最近一年使用:0次
名校
解题方法
7 . 下列关于氮、磷、砷的单质及化合物的说法正确的是


A.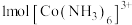 中含有 中含有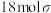 键 键 |
B.白磷分子 是极性分子,白磷可保存在水中 是极性分子,白磷可保存在水中 |
C.肼 的沸点为113.5℃,说明肼分子间可能存在氢键 的沸点为113.5℃,说明肼分子间可能存在氢键 |
| D.砷化镓的晶胞结构如图所示,镓原子配位数为8 |
您最近一年使用:0次
2021-10-16更新
|
395次组卷
|
4卷引用:山东省威海乳山市银滩高级中学2021-2022学年高二12月月考化学试题
解题方法
8 .  是具有重要发展前景的二次电池电极材料。南京工业大学和中科院物理所科研团队通过研究实现了镁电池
是具有重要发展前景的二次电池电极材料。南京工业大学和中科院物理所科研团队通过研究实现了镁电池 正极材料的稳定储镁。回答下列问题:
正极材料的稳定储镁。回答下列问题:
(1)铁元素在周期表中的位置是_______ ,其基态原子核外电子有_______ 种空间运动状态。
(2)下列状态的镁中,电离最外层一个电子所需能量最大的是_______ (填序号)。
① ②
② ③
③ ④
④
(3)原子中的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的S原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的S原子,其价电子自旋磁量子数的代数和为_______ 。
(4)依据第3周期元素第一电离能的变化规律,参照如图 、S元素的位置,用小黑点标出Al、Si、P三种元素的相对位置
、S元素的位置,用小黑点标出Al、Si、P三种元素的相对位置_______ 。

(5) 比
比 氧化性更
氧化性更_______ (填“强”或“弱”),从结构上分析,其原因是_______ 。
 是具有重要发展前景的二次电池电极材料。南京工业大学和中科院物理所科研团队通过研究实现了镁电池
是具有重要发展前景的二次电池电极材料。南京工业大学和中科院物理所科研团队通过研究实现了镁电池 正极材料的稳定储镁。回答下列问题:
正极材料的稳定储镁。回答下列问题:(1)铁元素在周期表中的位置是
(2)下列状态的镁中,电离最外层一个电子所需能量最大的是
①
 ②
② ③
③ ④
④
(3)原子中的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的S原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的S原子,其价电子自旋磁量子数的代数和为(4)依据第3周期元素第一电离能的变化规律,参照如图
 、S元素的位置,用小黑点标出Al、Si、P三种元素的相对位置
、S元素的位置,用小黑点标出Al、Si、P三种元素的相对位置
(5)
 比
比 氧化性更
氧化性更
您最近一年使用:0次
名校
9 . 下列化学用语表示不正确的是
A. 的球棍模型: 的球棍模型: |
B.sp2杂化轨道模型: |
C.HIO的电子式: |
D.用原子轨道描述氯化氢分子中化学键的形成: |
您最近一年使用:0次
2021-07-12更新
|
240次组卷
|
2卷引用:山东省威海乳山市第一中学2021-2022学年高二上学期12月月考化学试题
名校
10 . 已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示:
(1)元素M是___________ (填写元素符号),常见化合价为___________ 。
(2)硫原子核外有___________ 种不同运动状态的电子,有___________ 个非空轨道,有___________ 种不同形状的电子云。
(3)写出碳原子最外层电子的电子排布图___________ ,该化学用语不能表达出碳原子最外层电子的___________ (填字母)。
a.能层 b.能级 c.所有电子云的伸展方向 d.自旋状态
| I1 | I2 | I3 | I4 | |
| 电离能(kJ·mol-1) | 578 | 1817 | 2745 | 11578 |
(2)硫原子核外有
(3)写出碳原子最外层电子的电子排布图
a.能层 b.能级 c.所有电子云的伸展方向 d.自旋状态
您最近一年使用:0次



