解题方法
1 . 下列说法中正确的是
| A.分子中键能越大,键角越大,则分子越稳定 |
| B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子可能形成共价键 |
| C.水分子可表示为H-O-H,分子中键角为180° |
| D.H-O键键能为463KJ/mol,即18gH2O分解成H2和O2时,消耗能量为926kJ |
您最近一年使用:0次
名校
2 . 由金、氯、铯三种元素组成的晶体M的晶胞结构如图所示( 为铯,
为铯, 为氯,
为氯, 为金),其中金原子有两种不同的化学环境,形成2种−1价的配离子。设阿伏加德罗常数的值为NA,下列说法错误的是
为金),其中金原子有两种不同的化学环境,形成2种−1价的配离子。设阿伏加德罗常数的值为NA,下列说法错误的是

 为铯,
为铯, 为氯,
为氯, 为金),其中金原子有两种不同的化学环境,形成2种−1价的配离子。设阿伏加德罗常数的值为NA,下列说法错误的是
为金),其中金原子有两种不同的化学环境,形成2种−1价的配离子。设阿伏加德罗常数的值为NA,下列说法错误的是
| A.M的化学式为CsAuCl |
B.金原子形成的两种配离子分别为AuCl 、AuCl 、AuCl |
| C.位于体心的Au处于由Au构成的八面体空隙中 |
D.金晶体(Au)是面心立方堆积,其晶胞参数为408pm,金晶体密度为 g∙cm−3 g∙cm−3 |
您最近一年使用:0次
2022-09-11更新
|
343次组卷
|
2卷引用:辽宁省抚顺市第二中学2021-2022学年高三上学期10月月考化学试题
名校
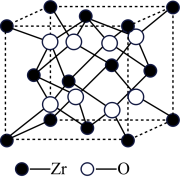
3 . 铁有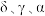 三种同素异形体,其晶胞结构如图所示,设NA为阿伏加德罗常数的值。下列说法正确的是
三种同素异形体,其晶胞结构如图所示,设NA为阿伏加德罗常数的值。下列说法正确的是
 三种同素异形体,其晶胞结构如图所示,设NA为阿伏加德罗常数的值。下列说法正确的是
三种同素异形体,其晶胞结构如图所示,设NA为阿伏加德罗常数的值。下列说法正确的是
A. 晶胞中含有2个铁原子,每个铁原子等距离且最近的铁原子有6个 晶胞中含有2个铁原子,每个铁原子等距离且最近的铁原子有6个 |
B.晶体的空间利用率: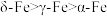 |
C. 晶胞中的原子堆积方式为体心立方堆积 晶胞中的原子堆积方式为体心立方堆积 |
D.铁原子的半径为acm,则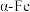 晶胞的密度为 晶胞的密度为 |
您最近一年使用:0次
2022-04-22更新
|
352次组卷
|
7卷引用:河北省唐山市曹妃甸区第一中学2020-2021学年高二下学期6月月考化学试题
名校
解题方法
4 . 钠离子电池是被认为在基于电网的储能系统中最具发展前景,双金属硫化物 空心纳米棒将有助于提高钠离子电池性能。回答下列问题:
空心纳米棒将有助于提高钠离子电池性能。回答下列问题:
(1) 位于第五周期,与N同主族,基态
位于第五周期,与N同主族,基态 的价电子排布图(轨道表达式)为
的价电子排布图(轨道表达式)为___________ ,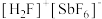 (氟酸锑)是一种超强酸,
(氟酸锑)是一种超强酸, 的空间构型为
的空间构型为___________ ,与 具有相同空间构型和键合形式的阴离子为
具有相同空间构型和键合形式的阴离子为___________ 。
(2) Si、P与S是同周期中相邻的元素,Si、P、S的电负性由大到小的顺序是___________ ,第一电离能由大到小的顺序是___________ 。
(3)与S同主族的元素有O、Se、Te等,它们氢化物的沸点大小为 ,其原因是
,其原因是___________ 。
(4)已知: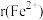 为
为 ,
, 为
为 。在隔绝空气条件下分别加热
。在隔绝空气条件下分别加热 和
和 ,实验测得
,实验测得 的分解温度低于
的分解温度低于 ,原因是
,原因是___________ 。
(5)某离子型铁的氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为___________ ;已知该晶体的密度为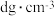 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的晶胞参数
,则该晶体的晶胞参数
___________  (用含d和
(用含d和 的代数式表示)。
的代数式表示)。

 空心纳米棒将有助于提高钠离子电池性能。回答下列问题:
空心纳米棒将有助于提高钠离子电池性能。回答下列问题:(1)
 位于第五周期,与N同主族,基态
位于第五周期,与N同主族,基态 的价电子排布图(轨道表达式)为
的价电子排布图(轨道表达式)为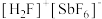 (氟酸锑)是一种超强酸,
(氟酸锑)是一种超强酸, 的空间构型为
的空间构型为 具有相同空间构型和键合形式的阴离子为
具有相同空间构型和键合形式的阴离子为(2) Si、P与S是同周期中相邻的元素,Si、P、S的电负性由大到小的顺序是
(3)与S同主族的元素有O、Se、Te等,它们氢化物的沸点大小为
 ,其原因是
,其原因是(4)已知:
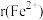 为
为 ,
, 为
为 。在隔绝空气条件下分别加热
。在隔绝空气条件下分别加热 和
和 ,实验测得
,实验测得 的分解温度低于
的分解温度低于 ,原因是
,原因是(5)某离子型铁的氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为
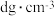 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的晶胞参数
,则该晶体的晶胞参数
 (用含d和
(用含d和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2021-12-31更新
|
1190次组卷
|
4卷引用:八省八校(T8联考)2021-2022学年高三上学期第一次联考化学试题(石家庄二中)
八省八校(T8联考)2021-2022学年高三上学期第一次联考化学试题(石家庄二中)(已下线)2022年湖南卷高考真题变式题(15-19)(已下线)2022年全国甲卷高考真题变式题(非选择题)吉林省双辽市一中、大安市一中、通榆县一中等重点高中2021-2022学年高三上学期期末联考理科综合化学试题
名校
解题方法
5 . 由于铁氮化合物具有非常优异的磁性能、机械性能和耐腐蚀性,受到研究人员的广泛关注。γˊ−Fe4N是一种性能优异的铁氮化合物,其可由氨气与羰基铁粉[Fe(CO)5]反应得到。
(1)Fe变为Fe2+时是失去___________ 轨道电子,Fe3+价层电子排布图为___________ 。
(2)氨气中N的杂化类型是___________ ,NH3中H−N−H的键角比NH4+中H−N−H的键角___________ (填“大”或“小”),理由是___________ 。
(3) 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有___________ (填标号)。
A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是___________ ,配位原子为___________ 。
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为___________ 。
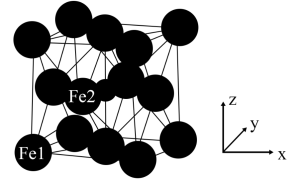
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为( ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为___________ 。已知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数a为___________ nm(用含d和NA的代数式表示)。
(1)Fe变为Fe2+时是失去
(2)氨气中N的杂化类型是
(3)
 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为(
 ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为
您最近一年使用:0次
2021-12-31更新
|
288次组卷
|
5卷引用:石家庄示范性高中2022届高三上学期调研考试化学试题
名校
6 . 全固态激光器所用的磷酸钛氧钾、氟硼铍酸钾是一种非线性光学晶体,我国是率先掌握通过非线性光学晶体变频来获得深紫外激光技术的国家,回答下列问题。
(1)写出Ti基态原子的价电子排布式___________ , 电子占据的轨道数为
电子占据的轨道数为___________ 个。
(2)Be和B的第一电离能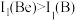 的原因是
的原因是___________ 。
(3) 在水溶液中存在解离反应:H
在水溶液中存在解离反应:H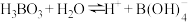 ,
, 中存在配位键,其中B原子的杂化类型是
中存在配位键,其中B原子的杂化类型是___________ ,从原子结构分析 中能形成配位键的原因是
中能形成配位键的原因是___________ 。
(4)氟硼酸钾是制备氟硼铍酸钾的原料之一,氟硼酸钾在高温下分解为KF和 ,二者的沸点分别为1500℃、-101℃。KF的沸点远高于
,二者的沸点分别为1500℃、-101℃。KF的沸点远高于 的原因是
的原因是___________ 。
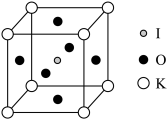
(5) 晶体也是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为
晶体也是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为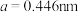 ,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为
,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为___________ (保留三位有效数字)nm,与K紧邻的O个数为___________ 。
(1)写出Ti基态原子的价电子排布式
 电子占据的轨道数为
电子占据的轨道数为(2)Be和B的第一电离能
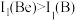 的原因是
的原因是(3)
 在水溶液中存在解离反应:H
在水溶液中存在解离反应:H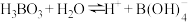 ,
, 中存在配位键,其中B原子的杂化类型是
中存在配位键,其中B原子的杂化类型是 中能形成配位键的原因是
中能形成配位键的原因是(4)氟硼酸钾是制备氟硼铍酸钾的原料之一,氟硼酸钾在高温下分解为KF和
 ,二者的沸点分别为1500℃、-101℃。KF的沸点远高于
,二者的沸点分别为1500℃、-101℃。KF的沸点远高于 的原因是
的原因是(5)
 晶体也是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为
晶体也是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为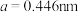 ,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为
,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为
您最近一年使用:0次
名校
解题方法
7 . 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的; F原子最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(注:A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D的第一电离能由小到大的顺序为___________ (用元素符号表示)。
(2)B的氯化物的熔点比MgO的熔点___________ (填“高”或“低”)。
(3)F的外围电子排布式是___________ 。
(4)A、F形成某种化合物的晶胞结构如图所示(其中A显−3价),则其化学式为___________ (每个球均表示1个原子)。
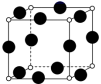
(5)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为___________ 。
(1)A、B、C、D的第一电离能由小到大的顺序为
(2)B的氯化物的熔点比MgO的熔点
(3)F的外围电子排布式是
(4)A、F形成某种化合物的晶胞结构如图所示(其中A显−3价),则其化学式为

(5)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为
您最近一年使用:0次
2021-10-19更新
|
204次组卷
|
2卷引用:江苏省淮安市涟水县第一中学2022届高三第一次阶段检测化学试卷
8 . 研究发现,在 低压合成甲醇的反应(
低压合成甲醇的反应(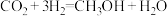 )中,钴氧化物负载的锰氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
)中,钴氧化物负载的锰氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
(2)基态 原子核外一共有
原子核外一共有___________ 种不同运动状态的电子。
(3) 和
和 分子中
分子中 原子的杂化类型分别为
原子的杂化类型分别为___________ 和___________ 。
(4) 是制备上述反应催化剂的原料,
是制备上述反应催化剂的原料, 的空间构型为
的空间构型为___________ ,与 互为等电子体的分子为
互为等电子体的分子为___________ (任写一种)。
(5)在 、
、 、
、 三种物质中,沸点从高到低的顺序为
三种物质中,沸点从高到低的顺序为___________ ,原因是___________ 。
(6)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为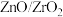 固溶体。四方
固溶体。四方 晶胞如图所示。
晶胞如图所示。 离子在晶胞中的配位数是
离子在晶胞中的配位数是___________ ,晶胞参数为 、
、 、
、 ,该晶体密度为
,该晶体密度为___________  (写出表达式即可)。在
(写出表达式即可)。在 中掺杂少量
中掺杂少量 后形成的催化剂,化学式可表示为
后形成的催化剂,化学式可表示为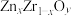 ,则y=
,则y=___________ (用含x的代数式表达)。
 低压合成甲醇的反应(
低压合成甲醇的反应(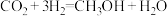 )中,钴氧化物负载的锰氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
)中,钴氧化物负载的锰氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)基态
 原子核外一共有
原子核外一共有(3)
 和
和 分子中
分子中 原子的杂化类型分别为
原子的杂化类型分别为(4)
 是制备上述反应催化剂的原料,
是制备上述反应催化剂的原料, 的空间构型为
的空间构型为 互为等电子体的分子为
互为等电子体的分子为(5)在
 、
、 、
、 三种物质中,沸点从高到低的顺序为
三种物质中,沸点从高到低的顺序为(6)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为
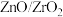 固溶体。四方
固溶体。四方 晶胞如图所示。
晶胞如图所示。 离子在晶胞中的配位数是
离子在晶胞中的配位数是 、
、 、
、 ,该晶体密度为
,该晶体密度为 (写出表达式即可)。在
(写出表达式即可)。在 中掺杂少量
中掺杂少量 后形成的催化剂,化学式可表示为
后形成的催化剂,化学式可表示为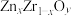 ,则y=
,则y=
您最近一年使用:0次
名校
解题方法
9 . 用NaBH4进行“化学镀”镀镍,可以得到坚硬、耐腐蚀的保护层(3Ni3B+Ni),反应的离子方程式为:20Ni2++16BH +34OH-+6H2O=2(3Ni3B+Ni)+10B(OH)
+34OH-+6H2O=2(3Ni3B+Ni)+10B(OH)  +35H2↑,下列说法不正确的是
+35H2↑,下列说法不正确的是
 +34OH-+6H2O=2(3Ni3B+Ni)+10B(OH)
+34OH-+6H2O=2(3Ni3B+Ni)+10B(OH)  +35H2↑,下列说法不正确的是
+35H2↑,下列说法不正确的是
A.1 mol B(OH)  含有σ键的数目为8NA 含有σ键的数目为8NA |
B.BH 的立体构型是正四面体形 的立体构型是正四面体形 |
| C.B原子核外电子的运动状态和能量均不相同 |
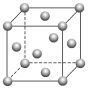
| D.Ni的晶胞结构如图所示,镍原子的配位数为12 |
您最近一年使用:0次
2021-08-28更新
|
339次组卷
|
4卷引用:江苏省苏州市相城区陆慕高级中学2021-2022学年高三上学期第一次阶段性诊断测试化学试题
江苏省苏州市相城区陆慕高级中学2021-2022学年高三上学期第一次阶段性诊断测试化学试题(已下线)2021年秋季高三开学摸底考化学试卷03(江苏专用)四川省内江市威远中学校2021-2022学年高二上学期期中考试化学试题辽宁省锦州市2019-2020学年高二下学期期末考试化学试卷
名校
10 . 下列化学用语表示不正确的是
A. 的球棍模型: 的球棍模型: |
B.sp2杂化轨道模型: |
C.HIO的电子式: |
D.用原子轨道描述氯化氢分子中化学键的形成: |
您最近一年使用:0次
2021-07-12更新
|
240次组卷
|
2卷引用:山东省威海乳山市第一中学2021-2022学年高二上学期12月月考化学试题



