1 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
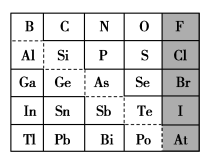
(1)Si的最高化合价为_______ ,Cl的最高价氧化物对应的水化物的化学式为_______ ,Bi的最高价氧化物的化学式为_______ 。
(2)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是_______ 元素(填元素符号)。
②酸性:
_______ (填“>”“<”或“=”,下同) 。
。
③氢化物的还原性:
_______  。
。
(3)N的氢化物和它的最高价含氧酸反应的化学方程式_______ 。

(1)Si的最高化合价为
(2)根据元素周期律,推断:
①阴影部分元素简单气态氢化物热稳定性最强的是
②酸性:

 。
。③氢化物的还原性:

 。
。(3)N的氢化物和它的最高价含氧酸反应的化学方程式
您最近一年使用:0次
名校
解题方法
2 . 为了庆祝元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。元素周期表反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。下表是元素周期表的一部分,数字①~⑦代表前四周期七种主族元素。请按题目要求回答下列问题:
(1)①~⑦对应元素中,非金属性最强的元素名称是_______ ;⑤在周期表中的位置为_______ 。
(2)②与③形成化合物的电子式为_______ ;①的最高价氧化物的结构式为_______ 。
(3)③、④、⑥三种元素最高价氧化物对应的水化物的碱性由强到弱的顺序是_______ (用化学式来回答)。
(4)①~⑦对应元素中,位于金属与非金属的分界线附近的是_______ (填对应的序号)。
| ① | ② | |||||||
| ③ | ④ | ⑤ | ||||||
| ⑥ | …… | ⑦ | ||||||
(2)②与③形成化合物的电子式为
(3)③、④、⑥三种元素最高价氧化物对应的水化物的碱性由强到弱的顺序是
(4)①~⑦对应元素中,位于金属与非金属的分界线附近的是
您最近一年使用:0次
2022-09-08更新
|
115次组卷
|
2卷引用:辽宁省锦州市2019-2020学年高一上学期期末考试化学试题
名校
解题方法
3 . 香花石是1958年中国地质学家发现的第一种世界新矿物,其主要成分的化学式为Ca3Li2(BeSiO4)3F2。回答下列问题:
(1)质子数与中子数相等的Ca原子的符号为________ 。
(2)Si在元素周期表的位置为________ 。
(3)香花石的主要成分的组成元素中,原子半径最小的是________ (填元素符号),原子半径最大的是________ (填元素符号)。
(1)质子数与中子数相等的Ca原子的符号为
(2)Si在元素周期表的位置为
(3)香花石的主要成分的组成元素中,原子半径最小的是
您最近一年使用:0次
4 . 如图是元素周期表的一部分。回答下列问题:
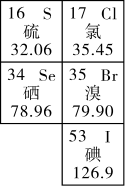
(1)溴被称为海洋元素。
①溴在元素周期表中位于第_______ 周期_______ 族。
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的酸是_______ (填化学式)。
(2)硒是人体必需的微量元素。
①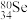 的中子数为
的中子数为_______ 。
②硒元素的气态氢化物的化学式为_______ 。
③ 溶于水生成
溶于水生成 ,向所得溶液中通入
,向所得溶液中通入 气体发生反应,生成硒单质和
气体发生反应,生成硒单质和 ,写出
,写出 与
与 反应的化学方程式:
反应的化学方程式:_______ 。
(3)溴化硒是一种重要的电子元件材料,其分子的球棍模型如图所示。下列说法正确的是_______ (填字母)。

a.溴化硒属于离子化合物
b.原子半径;
c. 元素的非金属性比
元素的非金属性比 的强
的强
d.溴化硒的相对分子质量约为318

(1)溴被称为海洋元素。
①溴在元素周期表中位于第
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的酸是
(2)硒是人体必需的微量元素。
①
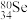 的中子数为
的中子数为②硒元素的气态氢化物的化学式为
③
 溶于水生成
溶于水生成 ,向所得溶液中通入
,向所得溶液中通入 气体发生反应,生成硒单质和
气体发生反应,生成硒单质和 ,写出
,写出 与
与 反应的化学方程式:
反应的化学方程式:(3)溴化硒是一种重要的电子元件材料,其分子的球棍模型如图所示。下列说法正确的是

a.溴化硒属于离子化合物
b.原子半径;

c.
 元素的非金属性比
元素的非金属性比 的强
的强d.溴化硒的相对分子质量约为318
您最近一年使用:0次
5 . 如图是氨元素的几种价态与物质类别的对应关系:

回答下列问题:
(1)写出氮元素在元素周期表的位置_______ 。
(2)从氢元素化合价分析, 具有氧化性和还原性。写出
具有氧化性和还原性。写出 生成A的化学反应方程式:
生成A的化学反应方程式:_______ ,这个反应 体现了
体现了_______ 性。
(3) 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为_______ 。写出用C检验 的存在的离子方程式
的存在的离子方程式_______ 。
(4)物质B为氮元素的气态氢化物,B的化学式为_______ ;实验室制取B的化学方程式为_______ 。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为_______ 。

回答下列问题:
(1)写出氮元素在元素周期表的位置
(2)从氢元素化合价分析,
 具有氧化性和还原性。写出
具有氧化性和还原性。写出 生成A的化学反应方程式:
生成A的化学反应方程式: 体现了
体现了(3)
 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为 的存在的离子方程式
的存在的离子方程式(4)物质B为氮元素的气态氢化物,B的化学式为
(5)浓硝酸与木炭在加热条件下反应的化学方程式为
您最近一年使用:0次
6 . 下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
(1)画出①和③两种元素的原子1:2组成的化合物的电子式_______ 。
(2)元素①-⑩中化学性质最不活泼的元素是_______ (填元素符号)。
(3)⑧的离子结构示意图为_______ 。
(4)用电子式表示③与⑤形成的原子个数比为1 ∶2的化合物的形成过程_______ 。
(5)由元素③、⑤、⑨形成的一种常见的杀菌消毒剂中存在的化学键有_______ 。
(6)硒(Se)被誉为“生命元素”,科学补硒可以减少疾病的发生。周期表中元素Se的位置在⑧的下方,下列推断正确的是_______(填字母序号)
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)元素①-⑩中化学性质最不活泼的元素是
(3)⑧的离子结构示意图为
(4)用电子式表示③与⑤形成的原子个数比为1 ∶2的化合物的形成过程
(5)由元素③、⑤、⑨形成的一种常见的杀菌消毒剂中存在的化学键有
(6)硒(Se)被誉为“生命元素”,科学补硒可以减少疾病的发生。周期表中元素Se的位置在⑧的下方,下列推断正确的是_______(填字母序号)
| A.SeO2具有还原性 | B.H2Se的稳定性比H2S强 |
| C.H2SeO4的酸性强于H2SO4 | D.SeO2在一定条件下可与NaOH溶液反应 |
您最近一年使用:0次
名校
7 . 根据要求完成。
(1)基态氟原子氟原子有_______ 种不同能量的电子,价电子排布图为_______ 。
(2)已知锡位于第五周期,与C同主族,写出Sn2+的最外层电子排布式:_______ ; 中有
中有_______ 种运动状态不同的电子。
(3)基态硼原子的核外电子排布图为_______ 。
(4)基态K原子中,核外电子占据最高能层的符号是_______ ,占据该能层电子的电子云轮廓图形状为_______ 。
(5)锰元素在周期表中的位置为_______ ;属于_______ 区元素(填“s”“p”“d”“ds”或“f”)。铜、锌两种元素的第一电离能、第二电离能如表所示:
铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是_______ 。
(1)基态氟原子氟原子有
(2)已知锡位于第五周期,与C同主族,写出Sn2+的最外层电子排布式:
 中有
中有(3)基态硼原子的核外电子排布图为
(4)基态K原子中,核外电子占据最高能层的符号是
(5)锰元素在周期表中的位置为
电离能/ |  |  |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
您最近一年使用:0次
名校
解题方法
8 . 我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为: S+2KNO3+3C=K2S+3CO2↑+N2↑。
请根据其中所含的元素回答下列问题:
(1)如图所示为元素周期表中钾元素框图,
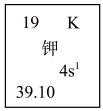
数据“39.10”表示的是___________ ;钾元素在周期表中的位置为___________ 。
(2)上述元素中,简单离子半径最大的元素,已知其氧化物中一种对应水化物能与氯单质反应,该反应的化学方程式是___________ 。
(3)上述反应生成物中,属于非电解质的是___________ (写结构式);生成物中含有离子键的物质电子式是___________ 。
(4)上述化学方程式的元素中,属于同周期元素的原子半径由大到小顺序为___________ ,它们的非金属性由强到弱的顺序为___________ ;列举一条能证明S和O非金属性强弱的实验事实___________ 。
请根据其中所含的元素回答下列问题:
(1)如图所示为元素周期表中钾元素框图,

数据“39.10”表示的是
(2)上述元素中,简单离子半径最大的元素,已知其氧化物中一种对应水化物能与氯单质反应,该反应的化学方程式是
(3)上述反应生成物中,属于非电解质的是
(4)上述化学方程式的元素中,属于同周期元素的原子半径由大到小顺序为
您最近一年使用:0次
名校
9 . 以下元素及物质与人类的生产生活紧密相关。完成下列填空:
(1)氯元素的原子结构示意图_______ ;氯与钠元素组成的化合物的电子式_______ 。
(2)钠、铝、铁三种元素中,_______ 元素是地壳中含量最高的金属元素,其在元素周期表中位于第_______ 周期_______ 族。
(3)以下不是铝、铁的共性的是_______
(4)浓硫酸具有强氧化性,它能与铜反应的化学方程式为_______ 。
(5)列举一个可以说明氯和硫非金属性强弱的事实_______ 。
(1)氯元素的原子结构示意图
(2)钠、铝、铁三种元素中,
(3)以下不是铝、铁的共性的是_______
| A.导电性 | B.导热性 | C.延展性 | D.能与碱溶液反应 |
(5)列举一个可以说明氯和硫非金属性强弱的事实
您最近一年使用:0次
10 . 1869年,门捷列夫总结出了元素周期表,还基于此预言了三种当时未被发现的元素,门捷列夫分别称它们为“类硼”、“类铝”与“类硅”。这三种元素在之后的几十年中陆续被发现,从而让人们意识到元素周期表具有重大价值。
(1)基态硼原子的最外层电子数为___________ 。“类硼”是与硼同族的第四周期元素,则“类硼”可能有的性质是___________ (填写下列字母)。
a.最高化合价为 b.该元素单质具有金属光泽
b.该元素单质具有金属光泽
c.该元素单质可与沸水反应置换出 d.该元素最高价氧化物对应水化物是强碱
d.该元素最高价氧化物对应水化物是强碱
(2)“类硼”最高价氯化物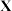 的熔点为
的熔点为 ,则
,则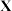 的化学式为
的化学式为___________ ,且该物质属于___________ 晶体。
(3)“类硅”与硅同族,且其基态原子中电子占据了4个能级组,则该元素处于第___________ 周期,其基态原子最外层有___________ 个未成对电子。“类硅”的原子半径___________ (填“>”、“<”或“=”)“类硼”的原子半径,“类硅”的电负性___________ (填“>”、“<”或“=”)“类硼”的电负性。
(4)“类铝”原子与铝原子具有相同的价电子数,与“类硼”是同一周期的两种不同元素。则“类铝”位于元素周期表___________ 区中,其基态原子的价电子的电子排布式为___________ 。
(1)基态硼原子的最外层电子数为
a.最高化合价为
 b.该元素单质具有金属光泽
b.该元素单质具有金属光泽c.该元素单质可与沸水反应置换出
 d.该元素最高价氧化物对应水化物是强碱
d.该元素最高价氧化物对应水化物是强碱(2)“类硼”最高价氯化物
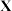 的熔点为
的熔点为 ,则
,则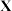 的化学式为
的化学式为(3)“类硅”与硅同族,且其基态原子中电子占据了4个能级组,则该元素处于第
(4)“类铝”原子与铝原子具有相同的价电子数,与“类硼”是同一周期的两种不同元素。则“类铝”位于元素周期表
您最近一年使用:0次
2022-06-29更新
|
237次组卷
|
3卷引用:上海交通大学附属中学2021-2022 学年高一下学期阶段性考试化学试题
上海交通大学附属中学2021-2022 学年高一下学期阶段性考试化学试题(已下线)专题03 晶体结构与性质-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(上海专用)福建省漳州市第三中学2022-2023学年高二下学期3月质量检测化学试题



