解题方法
1 . NaOH被大量用于制皂、造纸和纺织品生产。回答下列问题。
(1)H元素位于元素周期表的第________ 周期第IA族。
(2)Na元素位于第IA族H元素下方,Na的原子半径比H的______ (填“大”或“小”)。
(3)NaOH所含的两种非金属元素中,非金属性较强的是_______ (填“H”或“O”)。
(1)H元素位于元素周期表的第
(2)Na元素位于第IA族H元素下方,Na的原子半径比H的
(3)NaOH所含的两种非金属元素中,非金属性较强的是
您最近一年使用:0次
2023-09-23更新
|
193次组卷
|
3卷引用:黑龙江省七台河市第六中学2022-2023学年高一上学期期末考试化学试题
黑龙江省七台河市第六中学2022-2023学年高一上学期期末考试化学试题(已下线)【精品卷】4.2.2 元素周期表和元素周期律的应用课堂例题-人教版2023-2024学年必修第一册4.2.1 元素性质的周期性变化规律(基础)
2 . I.我国科学家在铁基高温超导体的研究上取得重大突破,发现了该超导体是由Fe、Ba、As三种元素组成,这为进一步理解超导配对机理及其与电荷密度波的关系提供了重要实验证据。回答下列问题:
(1)As元素属于元素周期表的___________ 区元素,其价电子排布式是___________ 。
(2)基态Fe原子核外电子排布式为___________ 。
Ⅱ.某元素原子的最外电子层只有一个电子,该电子的电子层数n=4。请回答下列问题:
(3)符合上述条件的元素共有___________ 种。
(4)在符合上述条件的元素中,原子序数最小的在元素周期表中的___________ 区(用符号填空),原子序数最大的在周期表的第___________ 周期、___________ 族。
(5)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+___________ (填“无”或“有”)颜色。
(1)As元素属于元素周期表的
(2)基态Fe原子核外电子排布式为
Ⅱ.某元素原子的最外电子层只有一个电子,该电子的电子层数n=4。请回答下列问题:
(3)符合上述条件的元素共有
(4)在符合上述条件的元素中,原子序数最小的在元素周期表中的
(5)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+
您最近一年使用:0次
解题方法
3 . 下表列出了A-R 9种元素在周期表中的位置
请回答下列问题。
(1)这9种元素分别为A___________ ,B、___________ ,C___________ ,D___________ ,E___________ ,F___________ ,G___________ 其中化学性质最不活泼的是___________ 。
(2)D元素的最高氧化物对应的水化合物与氢氧化钠反应的离子方程式___________ 。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为___________ 。
(4)F元素氢化物的化学式是___________ ,该氢化物在常温下与B发生反应的化学方程式是___________ 。
| 周期 | 族 | |||||||
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H | ||||||
(1)这9种元素分别为A
(2)D元素的最高氧化物对应的水化合物与氢氧化钠反应的离子方程式
(3)A、B、C三种元素按原子半径由大到小的顺序排列为
(4)F元素氢化物的化学式是
您最近一年使用:0次
2023-08-11更新
|
397次组卷
|
3卷引用:新疆疏勒县第一中学等3校2022-2023学年高一上学期1月期末考试化学试题
新疆疏勒县第一中学等3校2022-2023学年高一上学期1月期末考试化学试题新疆巴楚县第一中学2023-2024学年高一上学期1月期末化学试题(已下线)【精品卷】4.2.2 元素周期表和元素周期律的应用课堂例题-人教版2023-2024学年必修第一册
4 . 下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(1)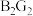 的电子式为
的电子式为___________ 。
(2)A分别与G、H、I形成的最简单化合物中,稳定性最强的是___________ (填化学式)。
(3)B、C、E、H四种元素对应的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(4)B、C形成的最高价氧化物对应水化物的碱性从强到弱的顺序为___________ (填化学式)。
(5)请写出B、E的最高价氧化物对应的水化物发生反应的化学方程式:___________ 。
| A | |||||||||||||||||
| G | I | ||||||||||||||||
| B | E | F | H | ||||||||||||||
| C | D | J |
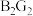 的电子式为
的电子式为(2)A分别与G、H、I形成的最简单化合物中,稳定性最强的是
(3)B、C、E、H四种元素对应的简单离子半径由大到小的顺序是
(4)B、C形成的最高价氧化物对应水化物的碱性从强到弱的顺序为
(5)请写出B、E的最高价氧化物对应的水化物发生反应的化学方程式:
您最近一年使用:0次
解题方法
5 . “价类二维图”是学习元素化合物的重要工具。下图是氮及其主要化合物的价类二维图。
(1)氮元素在元素周期表中的位置是___________ 。液态a可用作制冷剂的原因是___________ 。
(2)c、d、e三种物质中,属于酸性氧化物的是___________ (填化学式),判断理由是___________ (用离子方程式表示)。
(3)将充满d的大试管倒立于水槽中并轻轻晃动(如图),可观察到的实验现象为___________ 。
(5)为提高氮元素原子利用率,并减少环境污染,工业上用废铜屑、 溶液和稀硝酸制备
溶液和稀硝酸制备 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(6) 是一种高效氮肥,受热易分解。反应
是一种高效氮肥,受热易分解。反应 中,每生成
中,每生成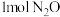 转移电子
转移电子___________ mol。
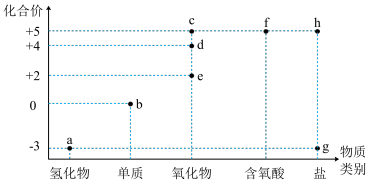
(1)氮元素在元素周期表中的位置是
(2)c、d、e三种物质中,属于酸性氧化物的是
(3)将充满d的大试管倒立于水槽中并轻轻晃动(如图),可观察到的实验现象为

| A.镁 | B.铝 | C.铜 | D.铂 |
 溶液和稀硝酸制备
溶液和稀硝酸制备 ,该反应的离子方程式为
,该反应的离子方程式为(6)
 是一种高效氮肥,受热易分解。反应
是一种高效氮肥,受热易分解。反应 中,每生成
中,每生成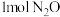 转移电子
转移电子
您最近一年使用:0次
名校
6 . 元素周期律
基于元素之间具有内在联系的思想,通过对元素性质及其关系的探寻,元素周期律已成为将物质组成元素性质以及原子结构建立联系的连接点。
(1)下列不属于主族元素的是________
(2) 的电子式正确的是________
的电子式正确的是________
(3)有关N、O两种元素,下列排序错误的是________
(4)甲~戊均为短周期元素,在元素周期表中的相对位置如图所示。戊的最高价氧化物对应的水化物为强酸。下列说法不正确的是________
基于元素之间具有内在联系的思想,通过对元素性质及其关系的探寻,元素周期律已成为将物质组成元素性质以及原子结构建立联系的连接点。
(1)下列不属于主族元素的是________
A. | B. | C. | D. |
 的电子式正确的是________
的电子式正确的是________A.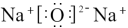 | B. |
C.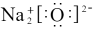 | D. |
| A.元素的最高化合价:O>N | B.简单氢化物的稳定性: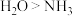 |
| C.元素的电负性:O>N | D.离子半径: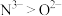 |
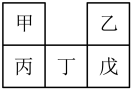
| A.原子半径:丁>戊>乙 |
| B.非金属性:戊>丁>丙 |
| C.甲的氢化物遇氯化氢一定有白烟产生 |
| D.丙的最高价氧化物对应的水化物一定能与强碱反应 |
您最近一年使用:0次
名校
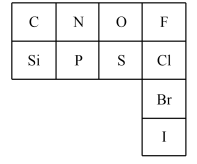
7 . 元素周期表是指导我们系统学习化学的重要工具。下图是元素周期表的一部分。___________ 相同。
(2)氮元素的最低化合价为___________ ,其气态氢化物的电子式为___________ 。在表中所列元素的最高价氧化物对应水化物中酸性最强的是___________ (写化学式)。
(3)Cl的非金属性___________ (填“强于”、“弱于”或“等于”)Br的非金属性。(海水提溴的原理是用氯气将溴离子氧化,请写出氯气与溴化钠溶液反应的化学方程式,并标出电子转移的方向和数目。___________ 。
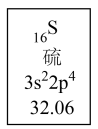
(4)元素周期表中每种元素的具体信息如图示例,从中你可以获取硫元素的哪些信息,请简要阐述。___________ (任写一个)。
(2)氮元素的最低化合价为
(3)Cl的非金属性
(4)元素周期表中每种元素的具体信息如图示例,从中你可以获取硫元素的哪些信息,请简要阐述。
您最近一年使用:0次
名校
8 . 德米特里·伊万诺维奇·门捷列夫是著名的俄国化学家,他对化学的发展作出了卓越的贡献。请回答下列问题:
(1)门捷列夫的突出贡献是________
(2)某元素的原子L层电子数比K层电子数多3个,与该元素同一主族的短周期元素是___________ 。
(3)C、O、Na的原子半径从大到小的顺序为___________ 。
(4)请你根据原子结构示意图,分别指出这些原子所含的质子数、元素周期表中的位置。___________ ,周期表中位置:___________ 。
(5)请将短周期元素或其化合物填入下列表格
①金属性最强的元素是___________ (填元素符号);
②形成化合物种类最多的元素是___________ (填元素符号);
③第三周期中,简单气态氢化物热稳定性最好的是___________ (填写分子式)。
(1)门捷列夫的突出贡献是________
| A.提出原子学说 | B.发现元素周期律 |
| C.提出分子学说 | D.发现氧气 |
(3)C、O、Na的原子半径从大到小的顺序为
(4)请你根据原子结构示意图,分别指出这些原子所含的质子数、元素周期表中的位置。

(5)请将短周期元素或其化合物填入下列表格
①金属性最强的元素是
②形成化合物种类最多的元素是
③第三周期中,简单气态氢化物热稳定性最好的是
您最近一年使用:0次
解题方法
9 . 根据①~⑧元素的编号所在周期表中的位置,用相应的元素符号 或者化学用语 回答有关问题:
(1)能显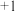 价,还能显
价,还能显 价的元素是
价的元素是_________ 。
(2)最高价氧化物对应水化物是强酸的元素是_________ 。
(3)最难形成化合物的元素是_________ 。
(4)①和④可形成原子数目比为1∶1的化合物,其电子式为_________ 。
(5)③、④、⑤分别与①形成的10电子分子的沸点由低到高的顺序为_________ 。
(6)⑥和⑦最高价氧化物对应水化物相互反应的离子方程式是________ 。
(7)第三周期某元素氢化物(组成为RH)能和冷水剧烈反应产生氢气,该反应的化学方程式为_____ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | |||||
3 | ⑥ | ⑦ | ⑧ |
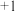 价,还能显
价,还能显 价的元素是
价的元素是(2)最高价氧化物对应水化物是强酸的元素是
(3)最难形成化合物的元素是
(4)①和④可形成原子数目比为1∶1的化合物,其电子式为
(5)③、④、⑤分别与①形成的10电子分子的沸点由低到高的顺序为
(6)⑥和⑦最高价氧化物对应水化物相互反应的离子方程式是
(7)第三周期某元素氢化物(组成为RH)能和冷水剧烈反应产生氢气,该反应的化学方程式为
您最近一年使用:0次
10 . 下图为元素周期表的一部分,请参照元素①~⑦在表中的位置,回答下列问题:

(1)元素⑥在周期表中的位置是___________ 。
(2)③④⑤的简单离子半径由大到小的顺序为___________ (用离子符号和“>”表示)。
(3)④和⑦形成的化合物中含有化学键类型为___________ 。
(4)④的最高价氧化物对应的水化物与⑥的最高价氧化物对应的水化物发生反应的离子方程式为___________ 。

(1)元素⑥在周期表中的位置是
(2)③④⑤的简单离子半径由大到小的顺序为
(3)④和⑦形成的化合物中含有化学键类型为
(4)④的最高价氧化物对应的水化物与⑥的最高价氧化物对应的水化物发生反应的离子方程式为
您最近一年使用:0次



