名校
解题方法
1 . 实验室加热液体时常加入沸石,其主要成分为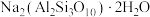 。根据其组成元素完成下列填空:
。根据其组成元素完成下列填空:
(1)元素Si在周期表中的位置是_______ 。
(2)沸石中的元素可形成多种化合物;Na元素与原子半径最小的元素组成化合物甲,常作强还原剂,化合物甲的电子式为_______ ;化合物乙可作为呼吸面具或潜艇氧气的来源,乙是_______ (填化学式);Na与同周期非金属性最强的元素形成的化合物可做调味品,用电子式表示该化合物的形成过程_______ 。
(3)与氧元素同周期的非金属元素中,简单气态氢化物最稳定的是_______ (填化学式)。
(4)Na所在周期的主族元素中,简单离子半径最小的是_______ (填离子符号)
(5)2022年我国科学家开始参与研究Uue新元素的合成。Uue与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则 中A=
中A=_______ 、Z=_______ 。
 。根据其组成元素完成下列填空:
。根据其组成元素完成下列填空:(1)元素Si在周期表中的位置是
(2)沸石中的元素可形成多种化合物;Na元素与原子半径最小的元素组成化合物甲,常作强还原剂,化合物甲的电子式为
(3)与氧元素同周期的非金属元素中,简单气态氢化物最稳定的是
(4)Na所在周期的主族元素中,简单离子半径最小的是
(5)2022年我国科学家开始参与研究Uue新元素的合成。Uue与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则
 中A=
中A=
您最近一年使用:0次
解题方法
2 . 核酸检测是常态化疫情防控的手段之一,核酸采样管中的红色液体是病毒核酸保存液,其成分之一的盐酸胍[结构简式为 ]的主要作用是使蛋白质变性并抑制酶活性。请回答以下问题:
]的主要作用是使蛋白质变性并抑制酶活性。请回答以下问题:
(1)下表是元素周期表中的短周期部分,请将盐酸胍中四种元素的元素符号填写在表中的相应位置。_____
(2)N位于元素周期表的第_______ 周期,第_______ 族。
(3)推测C、N的非金属性强弱:_______ 大于_______ 。
(4)HCl中所含化学键属于_______ ,请用电子式表示HCl的形成过程:_______ 。
 ]的主要作用是使蛋白质变性并抑制酶活性。请回答以下问题:
]的主要作用是使蛋白质变性并抑制酶活性。请回答以下问题:(1)下表是元素周期表中的短周期部分,请将盐酸胍中四种元素的元素符号填写在表中的相应位置。

(2)N位于元素周期表的第
(3)推测C、N的非金属性强弱:
(4)HCl中所含化学键属于
您最近一年使用:0次
3 . 合成氨是人类科学技术发展史上的一项重大成就,是化学和技术对社会发展与进步的巨大贡献。
(1)基态氮原子中,能量最高的电子的电子云在空间有_______ 个伸展方向。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为_______ 。
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。
①Cr原子的价电子排布图为_______ ;第四周期ds区元素中,与基态Cr原子最外层电子数目相同的元素的元素符号为_______ 。
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有_______ (填元素符号)
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①Mn在元素周期表中的位置_______ ,基态Mn原子未成对的电子数为_______ 。
②第三电离能
_______ 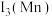 (填“>”或“<”),原因是
(填“>”或“<”),原因是_______ 。
(1)基态氮原子中,能量最高的电子的电子云在空间有
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。①Cr原子的价电子排布图为
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①Mn在元素周期表中的位置
②第三电离能

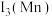 (填“>”或“<”),原因是
(填“>”或“<”),原因是
您最近一年使用:0次
2023-02-14更新
|
670次组卷
|
3卷引用:山东省泰安市2022-2023学年高二上学期期末考试化学试题
4 . 如图是元素周期表的一部分,回答下列问题。
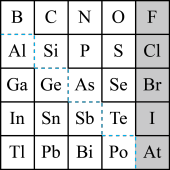
(1)元素 在元素周期表中的位置为
在元素周期表中的位置为_______ (写明周期数和族序数)。
(2) 的最高正价为
的最高正价为_______ , 的最高价氧化物为
的最高价氧化物为_______ (填化学式)。
(3)根据元素周期律推断:
①阴影部分元素最容易与氢气化合的是_______ (填元素符号)。
②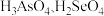 的酸性强弱:
的酸性强弱:
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③氢化物的还原性:
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找_______(填序号)。
(5)① 常用作溶剂,其电子式为
常用作溶剂,其电子式为_______ 。
②镓( )的化合物氮化镓(
)的化合物氮化镓( )和砷化镓(
)和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是_______ (填序号)。
A.原子半径: B.N的非金属性比O强
B.N的非金属性比O强
C. 的金属性比
的金属性比 弱 D.
弱 D. 和
和 的氧化物可能是两性氧化物
的氧化物可能是两性氧化物
(6)用如图装置证明酸性: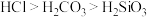 ,则溶液b为
,则溶液b为_______ 。下列事实可用于比较元素C与 非金属性相对强弱的是
非金属性相对强弱的是_______ (填序号)。
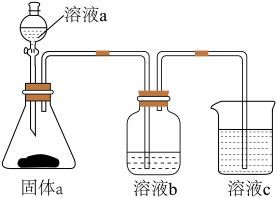
A.最高正化合价
B. 的氢化物比C的简单氢化物稳定
的氢化物比C的简单氢化物稳定
C. 的氢化物比C的简单氢化物沸点高
的氢化物比C的简单氢化物沸点高
D.最高价氧化物对应的水化物的酸性: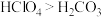

(1)元素
 在元素周期表中的位置为
在元素周期表中的位置为(2)
 的最高正价为
的最高正价为 的最高价氧化物为
的最高价氧化物为(3)根据元素周期律推断:
①阴影部分元素最容易与氢气化合的是
②
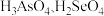 的酸性强弱:
的酸性强弱:
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③氢化物的还原性:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)可在图中分界线(虚线部分)附近寻找_______(填序号)。
| A.农药 | B.合金材料 | C.半导体材料 | D.优良的催化剂 |
 常用作溶剂,其电子式为
常用作溶剂,其电子式为②镓(
 )的化合物氮化镓(
)的化合物氮化镓( )和砷化镓(
)和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是A.原子半径:
 B.N的非金属性比O强
B.N的非金属性比O强C.
 的金属性比
的金属性比 弱 D.
弱 D. 和
和 的氧化物可能是两性氧化物
的氧化物可能是两性氧化物(6)用如图装置证明酸性:
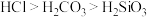 ,则溶液b为
,则溶液b为 非金属性相对强弱的是
非金属性相对强弱的是
A.最高正化合价

B.
 的氢化物比C的简单氢化物稳定
的氢化物比C的简单氢化物稳定C.
 的氢化物比C的简单氢化物沸点高
的氢化物比C的简单氢化物沸点高D.最高价氧化物对应的水化物的酸性:
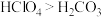
您最近一年使用:0次
名校
5 . A~R 9种元素在元素周期表中的位置如图。
回答下列问题:
(1)E的原子结构示意图为_______ 。
(2)常温下, 的状态为
的状态为_______ (填“液”、“固”或“气”)态。
(3)写出单质A与 在加热条件下发生反应的化学方程式:
在加热条件下发生反应的化学方程式:_______ 。
(4)化合物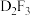 与NaOH溶液反应的离子方程式为
与NaOH溶液反应的离子方程式为_______ 。
(5)H元素形成的单质的用途有_______ (填一种即可)。
(6)最高价氧化物对应水化物的碱性:C_______ (填“>”、“<”或“=”)A,判断的理由为_______ 。
(7)化合物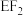 所含分子中的电子总数为
所含分子中的电子总数为_______ ,与其具有相同电子数的化合物分子为_______ (填标号)。
a. b.
b. c.
c. d.
d.
| 周期 | 族 | |||||||
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | A | E | F | |||||
| 3 | C | D | G | H | ||||
| 4 | B | R | ||||||
(1)E的原子结构示意图为
(2)常温下,
 的状态为
的状态为(3)写出单质A与
 在加热条件下发生反应的化学方程式:
在加热条件下发生反应的化学方程式:(4)化合物
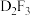 与NaOH溶液反应的离子方程式为
与NaOH溶液反应的离子方程式为(5)H元素形成的单质的用途有
(6)最高价氧化物对应水化物的碱性:C
(7)化合物
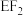 所含分子中的电子总数为
所含分子中的电子总数为a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
2023-02-08更新
|
154次组卷
|
3卷引用:贵州省黔东南州2023-2024学年高一上学期期末考试化学试题
名校
6 . 下图为元素周期表的一部分,请参照① ⑨在表中的位置,回答下列问题:
⑨在表中的位置,回答下列问题:
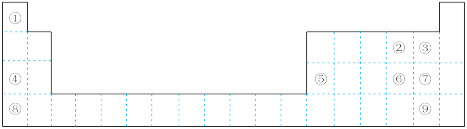
(1)最高价氧化物对应水化物碱性最强的是_______ (填化学式),氢化物热稳定性最强的是_______ (填电子式)。
(2)②③④的原子半径从大到小的顺序是_______ (填元素符号)。④⑤⑧的阳离子中氧化性最强的是_______ (填离子符号)。
(3)元素⑥的非金属性比⑦_______ (填“强”或“弱”),请从原子结构的角度解释:_______ 。
(4)现在含有元素硒( )的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多
)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多 个电子层,硒在周期表中的位置为
个电子层,硒在周期表中的位置为_______ ,则下列叙述中正确的是_______ 。
A.原子序数为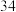
B.气态氢化物的稳定性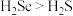
C. 不能与氢氧化钠反应
不能与氢氧化钠反应
D. 既有氧化性又有还原性
既有氧化性又有还原性
(5)①和④可形成 型离子化合物,该离子化合物的电子式为
型离子化合物,该离子化合物的电子式为_______ ,其与水反应放出气体的化学方程式为_______ 。
 ⑨在表中的位置,回答下列问题:
⑨在表中的位置,回答下列问题:
(1)最高价氧化物对应水化物碱性最强的是
(2)②③④的原子半径从大到小的顺序是
(3)元素⑥的非金属性比⑦
(4)现在含有元素硒(
 )的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多
)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多 个电子层,硒在周期表中的位置为
个电子层,硒在周期表中的位置为A.原子序数为
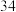
B.气态氢化物的稳定性
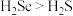
C.
 不能与氢氧化钠反应
不能与氢氧化钠反应D.
 既有氧化性又有还原性
既有氧化性又有还原性(5)①和④可形成
 型离子化合物,该离子化合物的电子式为
型离子化合物,该离子化合物的电子式为
您最近一年使用:0次
2023-02-05更新
|
278次组卷
|
2卷引用:湖南省郴州市苏仙区多校2022-2023学年高一上学期期末线上联考化学试题
名校
7 . I、下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:
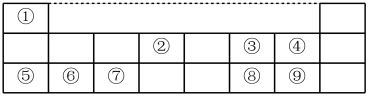
(1)元素⑧在周期表中的位置___________ ;
(2)在①~⑨元素中,某种元素的氧化物可用于呼吸面具中氧气来源,请写出该氧化物与二氧化碳反应的化学方程式___________ 。
(3)等质量的单质⑦分别与足量的稀硫酸和氢氧化钠溶液反应,相同条件下产生的气体体积之比为___________ 。
(4)元素⑨的单质可使湿润的淀粉-KI试纸变蓝,请写出离子方程式___________ 。
II、如图是某学校实验室从化学试剂商店采购的浓硫酸试剂标签上的部分内容。

(5)若实验室用该浓硫酸配制240mL0.5mol/L的稀硫酸,请计算需要该浓硫___________ mL(精确到小数点后1位)。
(6)配制过程中的正确操作顺序是:b、d___________ 、e(填“字母”)。
a、用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b、用量筒量取所需体积浓硫酸注入盛有约50mL蒸馏水的烧杯。
c、用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d、用玻璃棒慢慢搅动,混合均匀。
e、盖好容量瓶瓶塞,反复上下颠倒,摇匀。
f、将稀释后的H2SO4溶液沿玻璃棒注入250mL容量瓶。
g、往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
(7)下列操作将导致所配制的H2SO4溶液浓度偏大的是___________ 。
a、移液过程有H2SO4溶液溅出瓶外
b、移液后未洗涤烧杯和玻璃棒
c、定容时俯视容量瓶刻度线
d、加水超过刻度线,用胶头滴管吸出多余液体
e、洗涤时将量筒洗涤液也加入容量瓶

(1)元素⑧在周期表中的位置
(2)在①~⑨元素中,某种元素的氧化物可用于呼吸面具中氧气来源,请写出该氧化物与二氧化碳反应的化学方程式
(3)等质量的单质⑦分别与足量的稀硫酸和氢氧化钠溶液反应,相同条件下产生的气体体积之比为
(4)元素⑨的单质可使湿润的淀粉-KI试纸变蓝,请写出离子方程式
II、如图是某学校实验室从化学试剂商店采购的浓硫酸试剂标签上的部分内容。

(5)若实验室用该浓硫酸配制240mL0.5mol/L的稀硫酸,请计算需要该浓硫
(6)配制过程中的正确操作顺序是:b、d
a、用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b、用量筒量取所需体积浓硫酸注入盛有约50mL蒸馏水的烧杯。
c、用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d、用玻璃棒慢慢搅动,混合均匀。
e、盖好容量瓶瓶塞,反复上下颠倒,摇匀。
f、将稀释后的H2SO4溶液沿玻璃棒注入250mL容量瓶。
g、往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
(7)下列操作将导致所配制的H2SO4溶液浓度偏大的是
a、移液过程有H2SO4溶液溅出瓶外
b、移液后未洗涤烧杯和玻璃棒
c、定容时俯视容量瓶刻度线
d、加水超过刻度线,用胶头滴管吸出多余液体
e、洗涤时将量筒洗涤液也加入容量瓶
您最近一年使用:0次
8 . I.2020年12月17日,我国“嫦娥五号”返回器携月壤成功着陆。研究发现,月壤中存在天然的铁、金、银、铅、锌、铜、锑、铼等矿物颗粒。
(1)写出铜的基态原子的电子排布式:______ 。
(2)基态Fe原子有______ 个未成对电子,Fe3+的电子排布式为______ 。
(3)Fe在周期表中位于第______ 周期第______ 族,属于______ 区。
Ⅱ.回答下列问题:
(4)p电子的原子轨道呈______ 形。
(5)基态Al3+核外共有______ 种不同运动状态的电子。
(6)钒(V)元素广泛用于催化及钢铁工业,其价层电子的轨道表示式为_______ 。
(1)写出铜的基态原子的电子排布式:
(2)基态Fe原子有
(3)Fe在周期表中位于第
Ⅱ.回答下列问题:
(4)p电子的原子轨道呈
(5)基态Al3+核外共有
(6)钒(V)元素广泛用于催化及钢铁工业,其价层电子的轨道表示式为
您最近一年使用:0次
名校
9 . 下表列出9种元素在元素周期表(元素周期表只给出部分)中的位置
请回答下列问题:
(1)考古工作者利用某元素的一种核素测定一些文物的年代,这种核素的元素符号是_______ 。
(2)写出由元素②和元素④形成原子个数比为1∶2的化合物的电子式:_______ 。
(3)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式为_______
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是_______ (填化学式;用“>”连接)。
(5)表中的ⅠA族、ⅡA族元素全部是金属元素,这种判断_______ (填“正确”或“错误”);根据元素周期律,自然界中最强的碱是_______ (填化学式)。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | |||||
| 4 | ⑨ |
(1)考古工作者利用某元素的一种核素测定一些文物的年代,这种核素的元素符号是
(2)写出由元素②和元素④形成原子个数比为1∶2的化合物的电子式:
(3)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式为
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是
(5)表中的ⅠA族、ⅡA族元素全部是金属元素,这种判断
您最近一年使用:0次
2023-01-16更新
|
422次组卷
|
4卷引用:山东省莘县多校2022-2023学年高一上学期期末线上联考化学试题
山东省莘县多校2022-2023学年高一上学期期末线上联考化学试题江西省宜春市万载县万载二中 2023?2024 学年高一上学期期末模拟考试化学试卷(已下线)【知识图鉴】单元讲练测必修第一册第四单元03巩固练安徽省六安市金寨县青山中学2023-2024学年高一下学期第一次月考化学试题
名校
10 . 下表中阿拉伯数字(1、2……)是元素周期表中行或列的序号。请参照元素A~I在周期表中的位置,回答下列问题。
(1)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1∶1和1∶2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素以原子个数之比为1∶1和1∶2形成两种离子化合物Z和M。写出Z与Y反应的化学方程式:_______ 。
(2)I元素在周期表中的位置是第_______ 周期、第_______ 族。
(3)实验室中采用下图所示装置模拟工业上同时制取元素A和I的单质的过程。
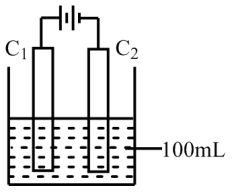
①写出电极C1上发生反应的电极反应式_______ 。
②当电极上产生112 mL(标准状况)元素I的单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=_______ 。(Kw=1.0×10-14)
纵行 横行 | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I |
(1)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1∶1和1∶2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素以原子个数之比为1∶1和1∶2形成两种离子化合物Z和M。写出Z与Y反应的化学方程式:
(2)I元素在周期表中的位置是第
(3)实验室中采用下图所示装置模拟工业上同时制取元素A和I的单质的过程。

①写出电极C1上发生反应的电极反应式
②当电极上产生112 mL(标准状况)元素I的单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=
您最近一年使用:0次



