1 . 元素周期表中周期与族的划分与原子结构的哪部分有关_____ ?
您最近一年使用:0次
2 . 填空
(1)砷原子的最外层电子排布式是4s24p3,在元素周期表中,砷元素位于第_____ 周期_____ 族;最高价氧化物的化学式为_____ ,砷酸钠的化学式是_____ 。
(2)已知下列元素在周期表中的位置,写出它们的价电子排布式和元素符号:
①第4周期ⅣB族_____ ;
②第5周期ⅦA族_____ 。
(1)砷原子的最外层电子排布式是4s24p3,在元素周期表中,砷元素位于第
(2)已知下列元素在周期表中的位置,写出它们的价电子排布式和元素符号:
①第4周期ⅣB族
②第5周期ⅦA族
您最近一年使用:0次
解题方法
3 . 铁是一种重要的元素,在成人体中的含量达44~5g,铁的配合物在有机合成、催化等领域中发挥重要作用。
Ⅰ.Fe³⁺的配合物在溶液中呈现不同的颜色,如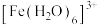 呈淡紫色(稀溶液时为无色),
呈淡紫色(稀溶液时为无色),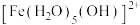 、
、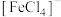 呈黄色。在黄色
呈黄色。在黄色 溶液中,加入稀
溶液中,加入稀 至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L
至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L NaCl溶液,溶液又变为黄色。
NaCl溶液,溶液又变为黄色。
(1)铁元素位于元素周期表的第___________ 周期第___________ 族。
(2)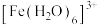 中,中心离子为
中,中心离子为___________ ,配位原子是___________ ,配位数为___________ 。
(3)加入NaCl溶液后,溶液又变为黄色的原因:___________ (用离子方程式表示)。
Ⅱ. 不易被人体吸收,维生素C可帮助人体将
不易被人体吸收,维生素C可帮助人体将 转变为易吸收的
转变为易吸收的 。
。
(4)维生素C的分子结构如下图所示,分子中碳原子的杂化方式有___________ ;推测维生素C在水中的溶解性:___________ (填“难溶于水”或“易溶于水”)。
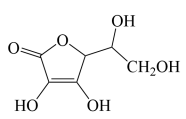
(5)根据维生素C的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。 (若不需要“可反应的试剂”,可对应填写“没有”)
②___________ 、___________ ;
③___________ 、___________ 、___________ 。
Ⅰ.Fe³⁺的配合物在溶液中呈现不同的颜色,如
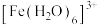 呈淡紫色(稀溶液时为无色),
呈淡紫色(稀溶液时为无色),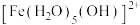 、
、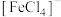 呈黄色。在黄色
呈黄色。在黄色 溶液中,加入稀
溶液中,加入稀 至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L
至溶液接近无色,再往该无色溶液加入3滴1 mol⋅L NaCl溶液,溶液又变为黄色。
NaCl溶液,溶液又变为黄色。(1)铁元素位于元素周期表的第
(2)
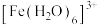 中,中心离子为
中,中心离子为(3)加入NaCl溶液后,溶液又变为黄色的原因:
Ⅱ.
 不易被人体吸收,维生素C可帮助人体将
不易被人体吸收,维生素C可帮助人体将 转变为易吸收的
转变为易吸收的 。
。(4)维生素C的分子结构如下图所示,分子中碳原子的杂化方式有

(5)根据维生素C的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。 (若不需要“可反应的试剂”,可对应填写“没有”)
| 序号 | 结构特征 | 可反应的试剂 | 反应类型 |
| ① | 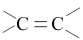 |  | 加成反应 |
| ② | 氧化反应 | ||
| ③ |
③
您最近一年使用:0次
4 . 人类赖以生存的大千世界是由众多物质组成的,而数量如此庞大的物质却仅由百余种化学元素组成。我们要探索元素性质的递变规律,理解原子是如何通过相互作用构建物质。
(1)下列说法不正确的是__________
(2)下列说法正确的是___________
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)4,Ni(CO)4呈正四面体形,Ni(CO)4易溶于下列物质中的__________
(4)氯原子最外层电子的原子轨道有___________ 种不同的伸展方向。
(5)写出与氯同周期,有3个未成对电子的基态原子的价电子轨道表示式为:___________ 。
(6)元素周期表中与氧元素相邻,且第一电离能比氧大的元素是___________ (填元素符号),它们与氧元素电负性由大到小的顺序为___________ 。
(7)根据价层电子对互斥理论判断下列问题:H2S中心原子的杂化方式为___________ 杂化,VSEPR构型为___________ ,分子的立体构型为___________ 。
(8)海洋元素中的氯、溴、碘统称为海水中的卤素资源,它们的化学性质既有相似性,也体现其递变性,用原子结构理论解释原因___________ 。
(1)下列说法不正确的是__________
A. 键是原子轨道以“肩并肩”方式相互重叠而形成的 键是原子轨道以“肩并肩”方式相互重叠而形成的 |
B.2个原子形成的多重共价键中,只能有一个是 键,而 键,而 键可以是一个或多个 键可以是一个或多个 |
C.s电子与s电子间形成的键是 键,p电子与p电子间形成的键是 键,p电子与p电子间形成的键是 键 键 |
| D.共价键一定有原子轨道的重叠 |
| A.氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少 |
| B.最外层电子数为ns2的元素都在元素周期表第2列 |
C.处于最低能量的原子叫做基态原子,1s22s22p →1s22s22p →1s22s22p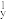 过程中形成的是发射光谱 过程中形成的是发射光谱 |
| D.已知某元素+3价基态离子的核外电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周期ⅥB族位置,属于d区 |
| A.水 | B.CCl4 | C.苯 | D.NiSO4溶液 |
(5)写出与氯同周期,有3个未成对电子的基态原子的价电子轨道表示式为:
(6)元素周期表中与氧元素相邻,且第一电离能比氧大的元素是
(7)根据价层电子对互斥理论判断下列问题:H2S中心原子的杂化方式为
(8)海洋元素中的氯、溴、碘统称为海水中的卤素资源,它们的化学性质既有相似性,也体现其递变性,用原子结构理论解释原因
您最近一年使用:0次
5 . C、N、O、F等元素的化合物在航天、美容、食品等多领域中有广泛的用途,请回答:
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为______ ;N、O、F的第一电离能由大到小的顺序为_____ (用元素符号表示)。
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为______ 晶体(填晶体类型)。
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第______ 周期第______ 族。
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO 的作用类型分别是
的作用类型分别是______ 、______ 。
A.离子键 B.配位键 C.氢键 D.金属键 中键角的大小并解释原因:
中键角的大小并解释原因:______ 。
(1)OF2主要用于火箭工程液体助燃剂,该分子的空间结构为
(2)XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为
(3)FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO
 的作用类型分别是
的作用类型分别是A.离子键 B.配位键 C.氢键 D.金属键
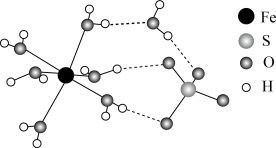
 中键角的大小并解释原因:
中键角的大小并解释原因:
您最近一年使用:0次
2023-04-20更新
|
197次组卷
|
3卷引用:山西省大同市2022-2023学年高二下学期期中考试化学试题
解题方法
6 . 亚硫酰氯( )在医药、农药合成领域有广泛的应用。
)在医药、农药合成领域有广泛的应用。
(1) 含有S、O、Cl三种元素,其中位于元素周期表中第二周期的元素是
含有S、O、Cl三种元素,其中位于元素周期表中第二周期的元素是_______ 。
(2)Cl的非金属性强于S的非金属性。
①用原子结构解释:Cl和S位于元素周期表中同一周期,原子核外电子层数相同,核电荷数Cl大于S,原子半径_______ ,得电子能力Cl强于S。
②用实验事实验证:将 通入
通入 溶液中,生成淡黄色沉淀。淡黄色沉淀是
溶液中,生成淡黄色沉淀。淡黄色沉淀是_______ 。
(3)下列关于 的说法正确的是
的说法正确的是_______ (填字母)。
a.属于化合物 b.摩尔质量为119 g·mol
 )在医药、农药合成领域有广泛的应用。
)在医药、农药合成领域有广泛的应用。(1)
 含有S、O、Cl三种元素,其中位于元素周期表中第二周期的元素是
含有S、O、Cl三种元素,其中位于元素周期表中第二周期的元素是(2)Cl的非金属性强于S的非金属性。
①用原子结构解释:Cl和S位于元素周期表中同一周期,原子核外电子层数相同,核电荷数Cl大于S,原子半径
②用实验事实验证:将
 通入
通入 溶液中,生成淡黄色沉淀。淡黄色沉淀是
溶液中,生成淡黄色沉淀。淡黄色沉淀是(3)下列关于
 的说法正确的是
的说法正确的是a.属于化合物 b.摩尔质量为119 g·mol

您最近一年使用:0次
23-24高一上·浙江·期末
解题方法
7 . 回答下列问题:
(1)小苏打的化学式:___________ ,CO2的电子式:___________ 。
(2)请写出红热的铁与水蒸气反应的化学方程式:___________ 。
(3)铯和钠属于同主族元素,铯原子核外有6个电子层,铯在元素周期表中的位置___________ 。
(1)小苏打的化学式:
(2)请写出红热的铁与水蒸气反应的化学方程式:
(3)铯和钠属于同主族元素,铯原子核外有6个电子层,铯在元素周期表中的位置
您最近一年使用:0次
8 . 回答下列问题:
(1)第四周期中,未成对电子数最多的元素是_______ 。(填名称)
(2)它位于第_______ 族。
(3)核外电子排布式是_______ 。
(4)它有_______ 个能层,_______ 个能级,_______ 种运动状态不同的电子。
(5)价电子排布图_______ 。
(6)属于_______ 区。
(1)第四周期中,未成对电子数最多的元素是
(2)它位于第
(3)核外电子排布式是
(4)它有
(5)价电子排布图
(6)属于
您最近一年使用:0次
解题方法
9 . 如下图所示,甲、乙、丙常温下都为气体,2 mol甲反应生成1 mol丙和3 mol乙。
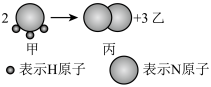
(1)同温同压下,生成丙和乙的体积比为_______ ,质量比为_______ 。
(2)甲分子的电子数为_______ ,丙元素在周期表中的位置是_______ 。

(1)同温同压下,生成丙和乙的体积比为
(2)甲分子的电子数为
您最近一年使用:0次
名校
10 . 已知 的3d轨道上有6个电子,试回答:
的3d轨道上有6个电子,试回答:
(1)M元素原子的核外电子排布式为_______ 。
(2)M元素在元素周期表中的位置为_______ 。
(3)M的基态原子共有_______ 种不同能级的电子,该原子最外层电子数为_______ ,价层电子数为_______ 。
(4)某元素原子的基态电子排布式为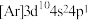 ,该元素处于元素周期表的第
,该元素处于元素周期表的第_______ 周期第_______ 族。试推测该元素处于元素周期表的_______ 区,该元素原子的价电子排布图为_______ 。
(5)与M元素相对比,铬(Cr)元素的原子核外电子排布有其特点,请写出Cr基态原子核外电子排布式_______ 。
 的3d轨道上有6个电子,试回答:
的3d轨道上有6个电子,试回答:(1)M元素原子的核外电子排布式为
(2)M元素在元素周期表中的位置为
(3)M的基态原子共有
(4)某元素原子的基态电子排布式为
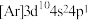 ,该元素处于元素周期表的第
,该元素处于元素周期表的第(5)与M元素相对比,铬(Cr)元素的原子核外电子排布有其特点,请写出Cr基态原子核外电子排布式
您最近一年使用:0次



