1 . 根据物质结构有关性质和特点,回答下列问题:
(1)钴位于元素周期表的___________ 。
(2)基态铝原子核外电子云轮廓图的形状有(填名称)___________ 。
(3)2020年新冠肺炎疫情席卷全球,酒精(CH3CH2OH)成为家庭必备品,乙醇分子中碳原子轨道的杂化类型是___________ 。
(4)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(III),是一种重要的配合物。该化合物中,所含非金属元素C的最高价氧化物的电子式为___________ ;Fe3+比Fe2+更稳定的原因___________ 。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________ 。
(6)高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为___________ ;
(1)钴位于元素周期表的
(2)基态铝原子核外电子云轮廓图的形状有(填名称)
(3)2020年新冠肺炎疫情席卷全球,酒精(CH3CH2OH)成为家庭必备品,乙醇分子中碳原子轨道的杂化类型是
(4)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(III),是一种重要的配合物。该化合物中,所含非金属元素C的最高价氧化物的电子式为
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为
(6)高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为
您最近一年使用:0次
2 . 回答下列问题:
(1)硼酸(H3BO3)为一元弱酸,电离方程式H3BO3+H2O H++B(OH)
H++B(OH) 。已知:H3BO3的电离常数Ka=5.8×10−10,H2CO3的电离常数Ka1=4.4×10−7、Ka2=4.7×10−11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
。已知:H3BO3的电离常数Ka=5.8×10−10,H2CO3的电离常数Ka1=4.4×10−7、Ka2=4.7×10−11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式_______ 。
(2)已知戊烷(C5H12)的3种同分异构体的沸点数据如下表:
请从物质结构角度分析,正戊烷、异戊烷、新戊烷沸点依次降低的原因是_______ 。
(3)某第四周期元素位于元素周期表中的第六纵行,则该元素位于元素周期表中_______ 区(按电子排布分区),其基态原子的价电子轨道表达式为_______ 。
(1)硼酸(H3BO3)为一元弱酸,电离方程式H3BO3+H2O
 H++B(OH)
H++B(OH) 。已知:H3BO3的电离常数Ka=5.8×10−10,H2CO3的电离常数Ka1=4.4×10−7、Ka2=4.7×10−11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
。已知:H3BO3的电离常数Ka=5.8×10−10,H2CO3的电离常数Ka1=4.4×10−7、Ka2=4.7×10−11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式(2)已知戊烷(C5H12)的3种同分异构体的沸点数据如下表:
| 正戊烷 | 异戊烷 | 新戊烷 | |
| 沸点/℃ | 36.1 | 27.9 | 9.5 |
(3)某第四周期元素位于元素周期表中的第六纵行,则该元素位于元素周期表中
您最近一年使用:0次
名校
解题方法
3 . 香花石是1958年中国地质学家发现的第一种世界新矿物,其主要成分的化学式为Ca3Li2(BeSiO4)3F2。回答下列问题:
(1)质子数与中子数相等的Ca原子的符号为________ 。
(2)Si在元素周期表的位置为________ 。
(3)香花石的主要成分的组成元素中,原子半径最小的是________ (填元素符号),原子半径最大的是________ (填元素符号)。
(1)质子数与中子数相等的Ca原子的符号为
(2)Si在元素周期表的位置为
(3)香花石的主要成分的组成元素中,原子半径最小的是
您最近一年使用:0次
名校
4 . 运用元素周期律和元素周期表,可以系统研究元素的性质。回答下列问题:
(1)碱金属元素中,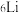 和
和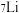 之间的关系是互为
之间的关系是互为_______ 。金属钾的氧化物有多种,其中过氧化钾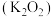 常作供氧剂,写出
常作供氧剂,写出 与
与 反应的化学方程式:
反应的化学方程式:_______ 。
(2)门捷列夫预言的“类硅”,后被发现,并命名为锗(Ge),周期表中排在硅的下一行。加上之前发现的碳(C)、铅(Pb)、锡(Sn),这一主族的元素趋于完善。
①锗在元素周期表中的位置是_______ ,根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是_______ 。
②硅和锗单质分别与 反应生成的氢化物更稳定的是
反应生成的氢化物更稳定的是_______ (填“硅”或“锗”)。
(1)碱金属元素中,
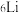 和
和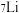 之间的关系是互为
之间的关系是互为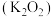 常作供氧剂,写出
常作供氧剂,写出 与
与 反应的化学方程式:
反应的化学方程式:(2)门捷列夫预言的“类硅”,后被发现,并命名为锗(Ge),周期表中排在硅的下一行。加上之前发现的碳(C)、铅(Pb)、锡(Sn),这一主族的元素趋于完善。
①锗在元素周期表中的位置是
②硅和锗单质分别与
 反应生成的氢化物更稳定的是
反应生成的氢化物更稳定的是
您最近一年使用:0次
5 . X、Y、Z是短周期主族元素,在元素周期表中相对位置如图所示:
已知:Y的最外层有4个电子。请回答下列问题:
(1)X元素的元素符号是_______ ;
(2)Y元素在周期表中位于第_______ 族;
(3)Z的氢化物中的化学键属于_______ (填“离子键”或“共价键”);
(4)化合物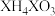 属于
属于_______ (填“酸”“碱”或“盐”)。
| X | ||
| Y | Z |
(1)X元素的元素符号是
(2)Y元素在周期表中位于第
(3)Z的氢化物中的化学键属于
(4)化合物
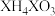 属于
属于
您最近一年使用:0次
名校
6 . 如图是元素周期表的一部分。表中所列的字母分别代表一种化学元素:
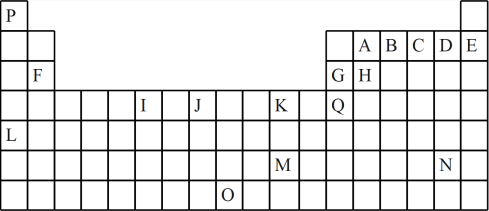
(1)I的最高化合价为___ ,J元素原子的价层电子排布图____ ,Q的元素名称是____ 。元素B、C、D的氢化物热稳定性由大到小是___ (填化学式)。
(2)下列正确的是____ 。
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(3)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是___ 。
a.L位于元素周期表中第5周期IA族,属于s区元素
b.O位于元素周期表中第7周期VIIIB族,属于d区元素
c.M的价层电子排布式为6s1,属于ds区元素
d.H所在族的价层电子排布式为ns2np2,属于p区元素
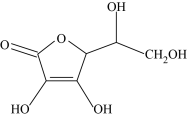
(4)元素P、A、C可以形成人体必需的抗坏血酸,其分子结构如图所示,推测抗坏血酸在水中的溶解性:____ (填“难溶”或“易溶”)于水;坏血酸分子有____ 个手性碳原子。

(1)I的最高化合价为
(2)下列正确的是
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(3)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是
a.L位于元素周期表中第5周期IA族,属于s区元素
b.O位于元素周期表中第7周期VIIIB族,属于d区元素
c.M的价层电子排布式为6s1,属于ds区元素
d.H所在族的价层电子排布式为ns2np2,属于p区元素
(4)元素P、A、C可以形成人体必需的抗坏血酸,其分子结构如图所示,推测抗坏血酸在水中的溶解性:

您最近一年使用:0次
名校
解题方法
7 . 为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:
(1)据汞的原子结构示意图 ,汞在第
,汞在第_______ 周期。
(2)①叠氮化钠(NaN3)可用于汽车安全气囊的产气药,NaN3在撞击时能发生分解反应生成两种单质。计算理论上65 gNaN3完全分解,释放出标准状况下的气体体积_______ L。
②氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,工业将氧化铝、氮气和碳在一定条件下反应制得AlN和CO,请将下列的化学反应方程式配平。_______
_______Al2O3+_______N2+_______C—______AlN+_______CO
(3)利用元素的化合价推测物质的性质是化学研究的重要于段。如图是硫元素的“价—类”二维图:

①从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______ (填化学式)。
②Z的浓溶液与铁单质在加热条件下可以发生化学反应生成Y,该反应的化学方程式为_______ 。
(1)据汞的原子结构示意图
 ,汞在第
,汞在第(2)①叠氮化钠(NaN3)可用于汽车安全气囊的产气药,NaN3在撞击时能发生分解反应生成两种单质。计算理论上65 gNaN3完全分解,释放出标准状况下的气体体积
②氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,工业将氧化铝、氮气和碳在一定条件下反应制得AlN和CO,请将下列的化学反应方程式配平。
_______Al2O3+_______N2+_______C—______AlN+_______CO
(3)利用元素的化合价推测物质的性质是化学研究的重要于段。如图是硫元素的“价—类”二维图:

①从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
②Z的浓溶液与铁单质在加热条件下可以发生化学反应生成Y,该反应的化学方程式为
您最近一年使用:0次
2022-04-20更新
|
378次组卷
|
2卷引用:黑龙江省哈尔滨市第九中学2021-2022学年高一上学期期末考试化学试题
名校
8 . 回答下列问题:
(1)鉴于 的存在,有人建议可把氢元素归到第ⅦA族。根据氢元素最高正化合价与最低负化合价的绝对值相等,也可把氢元素归到元素周期表中的
的存在,有人建议可把氢元素归到第ⅦA族。根据氢元素最高正化合价与最低负化合价的绝对值相等,也可把氢元素归到元素周期表中的_______ 族。
(2)甲元素 层上7个电子,甲元素与硫元素相比,非金属性较强的是
层上7个电子,甲元素与硫元素相比,非金属性较强的是_______ (填元素名称),写出可以验证该结论的一个化学方程式:_______ 。
(3)近年来“铊中毒”事件屡屡发生,铊再次成为公众关注的焦点。铊元素的相关信息如图所示。下列叙述不正确的是_______(填字母)。
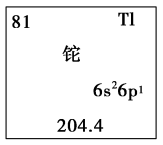
(1)鉴于
 的存在,有人建议可把氢元素归到第ⅦA族。根据氢元素最高正化合价与最低负化合价的绝对值相等,也可把氢元素归到元素周期表中的
的存在,有人建议可把氢元素归到第ⅦA族。根据氢元素最高正化合价与最低负化合价的绝对值相等,也可把氢元素归到元素周期表中的(2)甲元素
 层上7个电子,甲元素与硫元素相比,非金属性较强的是
层上7个电子,甲元素与硫元素相比,非金属性较强的是(3)近年来“铊中毒”事件屡屡发生,铊再次成为公众关注的焦点。铊元素的相关信息如图所示。下列叙述不正确的是_______(填字母)。

| A.铊元素在元素周期表中的位置是第六周期第ⅡA族 |
B.铊原子的中子数为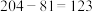 |
| C.铊原子有6个电子层,最外电子层上有3个电子 |
| D.铊元素的金属性比铝元素的强 |
您最近一年使用:0次
9 . 据周期表结构, 原子序数为85号的元素在周期表中的第_______ 周期,_______ 族。
您最近一年使用:0次
10 . ①在周期表的18个纵行16个族中,各族从左到右的排列顺序如何?请从左向右依次写出。_______
②在所有族中,元素最多的族是_______ 族。共有_______ 种元素。原因是什么?_____
②在所有族中,元素最多的族是
您最近一年使用:0次



