名校
解题方法
1 . 元素X、Y、Z、W均属前4周期,基态X原子的2p轨道中成对电子与未成对电子相等;Y是地壳含量最多的金属元素;Z的单质常温下是黄绿色气体;基态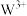 的3d轨道为半充满。下列说法正确的是
的3d轨道为半充满。下列说法正确的是
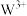 的3d轨道为半充满。下列说法正确的是
的3d轨道为半充满。下列说法正确的是
A.简单离子半径: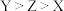 |
B.简单氢化物沸点: |
| C.Y与Z形成的化合物是电解质,熔融状态能导电 |
D. 晶胞的 晶胞的 结构如图所示, 结构如图所示,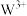 已标出, 已标出,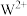 应位于c处 应位于c处 |
您最近一年使用:0次
2 . X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,a、b、c、d、e、f是这些元素组成的化合物,其转化关系如图所示,0.01mol/La溶液的pH=12,且焰色反应呈黄色,b是形成酸雨的主要成分,e是二元化合物,且0.01mol/Le溶液的pH=2,下列说法正确的是
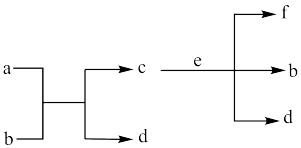
| A.原子半径:Q>W>Z>Y>X | B.简单氢化物的稳定性:Q>W |
| C.a、e、f均能抑制水的电离 | D.a、b、c、d、e、f均含有极性共价键 |
您最近一年使用:0次
3 . X、Y、Z、M、N是原子序数依次增大的前四周期元素,X、M、N的最外层电子数相等,且X的价电子数和原子序数相等,M是前四周期中金属性最强的元素,N的内层轨道全充满电子,Y的基态原子中共有4种不同的空间运动状态的电子,Z是电负性最强的元素。一种由Z、M、N三种元素组成的晶体的晶胞结构如图所示,下列说法正确的是
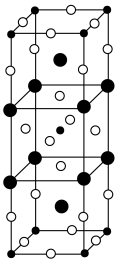

| A.原子半径:M>Z>Y>X |
| B.该晶体中N的化合价为+2 |
| C.X和Y形成的化合物的沸点低于X和Z形成的化合物的沸点 |
| D.该晶胞中N的配位数为8 |
您最近一年使用:0次
4 . X、Y、Z、W、M为原子序数依次增大的前四周期元素,5种元素组成的化合物M(YX3)4WZ常用作杀虫剂。其中Y的基态原子2p轨道半充满,Z为地壳中含量最高的元素,Z的核外电子数等于X、Y核外电子数之和,W和Z同族,M元素基态原子的内层电子全充满、最外层只有1个电子。下列说法错误的是
| A.原子半径:W>Y>Z |
| B.简单氢化物的稳定性:Y>Z |
| C.M元素位于周期表的ds区 |
D.YX3和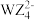 的中心原子杂化方式相同 的中心原子杂化方式相同 |
您最近一年使用:0次
名校
5 . 短周期主族元素V、W、X、Y、Z的原子序数依次增大。基态V原子核外3个能级上电子数相等,基态X原子核外s能级、p能级上电子总数相等。0.2molZ与足量的稀硫酸反应产生 (标准状况)。Y的部分电离能数据如下:
(标准状况)。Y的部分电离能数据如下:
下列叙述错误的是
 (标准状况)。Y的部分电离能数据如下:
(标准状况)。Y的部分电离能数据如下:| 电离能 |  |  |  |  |
( ) ) | 738 | 1451 | 7733 | 10540 |
| A.原子半径:Y>Z>V | B.第一电离能:V<W<X |
| C.简单氢化物的稳定性:V<W<X | D.最高价氧化物对应水化物的碱性:Z<Y |
您最近一年使用:0次
名校
6 .  是原子序数依次增大的四种短周期元素,X与另外三种元素不在同一周期,Y的最外层电子数比内层电子数多3个,Z和W同主族,由这四种元素与
是原子序数依次增大的四种短周期元素,X与另外三种元素不在同一周期,Y的最外层电子数比内层电子数多3个,Z和W同主族,由这四种元素与 元素组成的化合物M[化学式:
元素组成的化合物M[化学式: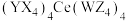 ]是分析化学常用的滴定剂。下列说法错误的是
]是分析化学常用的滴定剂。下列说法错误的是
 是原子序数依次增大的四种短周期元素,X与另外三种元素不在同一周期,Y的最外层电子数比内层电子数多3个,Z和W同主族,由这四种元素与
是原子序数依次增大的四种短周期元素,X与另外三种元素不在同一周期,Y的最外层电子数比内层电子数多3个,Z和W同主族,由这四种元素与 元素组成的化合物M[化学式:
元素组成的化合物M[化学式: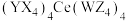 ]是分析化学常用的滴定剂。下列说法错误的是
]是分析化学常用的滴定剂。下列说法错误的是A.化合物M中 的化合价为 的化合价为 |
B.简单离子半径: |
C.与X形成的简单化合物的沸点: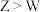 |
D.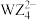 的空间结构为正四面体 的空间结构为正四面体 |
您最近一年使用:0次
真题
解题方法
7 . 氮和氧是构建化合物的常见元素。
(1)某化合物的晶胞如图,其化学式是_______ ,晶体类型是_______ 。
(2)下列说法正确的是_______。
(3)① ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为_______ ;比较键角 中的
中的
_______  中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由_______ 。
②将 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
_______  (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式_______ 。
已知: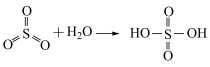
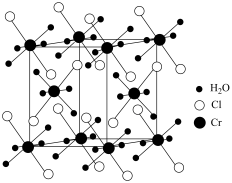
(1)某化合物的晶胞如图,其化学式是
(2)下列说法正确的是_______。
A.电负性: | B.离子半径: |
C.第一电离能: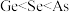 | D.基态 2+的简化电子排布式: 2+的简化电子排布式: |
(3)①
 ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为 中的
中的
 中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由②将
 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
 (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式
您最近一年使用:0次
解题方法
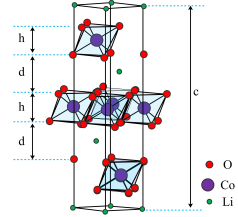
8 . 钴酸锂(LiCoO2)是常见的锂离子电池正极材料,其晶胞结构示意图如图。晶体中O围绕Co形成八面体,八面体共棱形成带负电的层状空间结构,与Li+层交替排列。在充放电过程中,Li+在层间脱出或嵌入。
(1)下列Li原子电子排布图表示的状态中,能量最低的是______ 。
(2)Li+与H-具有相同的电子构型,离子半径r(Li+)小于r(H-)的主要原因是______ 。
(3)观察该晶胞图示,其中Li处于晶胞顶点或晶胞内部,Co处于晶胞内部或晶胞侧棱上,而O的位置不易观察。结合钴酸锂(LiCoO2)化学式,可推断该晶胞中O的个数为______ 。
(4)晶胞底面为菱形,晶胞高度为cnm,Co和O组成八面体层高度为hnm,计算两层间的距离d=______ nm。(列出计算式)
(5)Li+在______ (填“充电”或“放电”)过程中会从八面体层间脱出。该过程会导致晶胞高度c变大,解释原因:______ 。

(1)下列Li原子电子排布图表示的状态中,能量最低的是
A.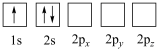 | B.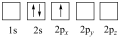 |
C.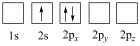 | D. |
(2)Li+与H-具有相同的电子构型,离子半径r(Li+)小于r(H-)的主要原因是
(3)观察该晶胞图示,其中Li处于晶胞顶点或晶胞内部,Co处于晶胞内部或晶胞侧棱上,而O的位置不易观察。结合钴酸锂(LiCoO2)化学式,可推断该晶胞中O的个数为
(4)晶胞底面为菱形,晶胞高度为cnm,Co和O组成八面体层高度为hnm,计算两层间的距离d=
(5)Li+在
您最近一年使用:0次
名校
9 . 化合物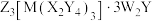 由位于前四周期且原子序数依次增大的W、X、Y、Z、M五种元素组成。M在地壳中的含量居第四位且其原子序数等于W、X、Z的原子序数之和。该化合物的热重曲线如图所示,150℃~600℃阶段,只有XY和XY2两种无刺激性气体逸出,600℃所得固体为Z2XY3和氧化物Q的混合物。下列说法错误的是
由位于前四周期且原子序数依次增大的W、X、Y、Z、M五种元素组成。M在地壳中的含量居第四位且其原子序数等于W、X、Z的原子序数之和。该化合物的热重曲线如图所示,150℃~600℃阶段,只有XY和XY2两种无刺激性气体逸出,600℃所得固体为Z2XY3和氧化物Q的混合物。下列说法错误的是

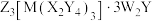 由位于前四周期且原子序数依次增大的W、X、Y、Z、M五种元素组成。M在地壳中的含量居第四位且其原子序数等于W、X、Z的原子序数之和。该化合物的热重曲线如图所示,150℃~600℃阶段,只有XY和XY2两种无刺激性气体逸出,600℃所得固体为Z2XY3和氧化物Q的混合物。下列说法错误的是
由位于前四周期且原子序数依次增大的W、X、Y、Z、M五种元素组成。M在地壳中的含量居第四位且其原子序数等于W、X、Z的原子序数之和。该化合物的热重曲线如图所示,150℃~600℃阶段,只有XY和XY2两种无刺激性气体逸出,600℃所得固体为Z2XY3和氧化物Q的混合物。下列说法错误的是
| A.第一电离能:W>Z |
| B.简单离子半径:Z>Y>W |
| C.氧化物Q为M2Y3 |
| D.150℃~600℃阶段热分解生成的XY和XY2的物质的量之比为5:4 |
您最近一年使用:0次
2023-05-31更新
|
517次组卷
|
3卷引用:湖北省武汉市华中师范大学附属中学2022-2023学年高三下学期5月适应性考试化学试题
解题方法
10 .  是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
(1) 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为___________ 。
(2) 可形成
可形成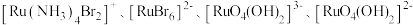 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是___________ ,具有对称结构的 中
中 为
为___________ 。图1中通过螯合作用形成配位键的N原子的杂化方式为___________ , 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是___________ 。

(3) 的晶体结构如图2所示。
的晶体结构如图2所示。
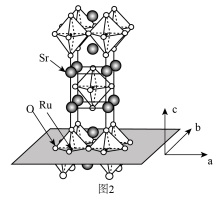
① 和
和 的电负性:
的电负性:
___________  (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为___________ 形。
②用 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为___________  (列出计算式即可)。
(列出计算式即可)。
 是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:(1)
 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为(2)
 可形成
可形成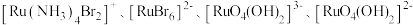 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是 中
中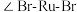 为
为 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是
(3)
 的晶体结构如图2所示。
的晶体结构如图2所示。
①
 和
和 的电负性:
的电负性:
 (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为②用
 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次



