1 . 钇及其化合物在航天、电子、超导等方面有着广泛的应用,工业上以硅铍钇矿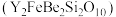 为原料生产氧化钇(
为原料生产氧化钇( )。
)。
(1)钇(Y)与钪同族,位于元素周期表中钪(Sc)的下一周期,基态钇(Y)原子的价电子排布图为______ ,与 元素同周期的基态原子中,未成对电子数与
元素同周期的基态原子中,未成对电子数与 原子相同的元素还有种
原子相同的元素还有种________ 。
(2)在元素周期表中, 和
和 处于第二周期和第三周期的对角线位置,化学性质相似。
处于第二周期和第三周期的对角线位置,化学性质相似。
①写出 的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:
的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:___________ 。
②已知 元素和
元素和 元素的电负性分别为1.5和4.0,则它们形成的化合物是
元素的电负性分别为1.5和4.0,则它们形成的化合物是_______ (填“离子化合物”或“共价化合物”)。
(3) 与
与 均为第二周期元素:
均为第二周期元素:
① 元素的原子核外共有
元素的原子核外共有____ 种不同空间运动状态的电子。
②电离能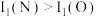 ,原因是
,原因是__________ 。
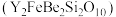 为原料生产氧化钇(
为原料生产氧化钇( )。
)。(1)钇(Y)与钪同族,位于元素周期表中钪(Sc)的下一周期,基态钇(Y)原子的价电子排布图为
 元素同周期的基态原子中,未成对电子数与
元素同周期的基态原子中,未成对电子数与 原子相同的元素还有种
原子相同的元素还有种(2)在元素周期表中,
 和
和 处于第二周期和第三周期的对角线位置,化学性质相似。
处于第二周期和第三周期的对角线位置,化学性质相似。①写出
 的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:
的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:②已知
 元素和
元素和 元素的电负性分别为1.5和4.0,则它们形成的化合物是
元素的电负性分别为1.5和4.0,则它们形成的化合物是(3)
 与
与 均为第二周期元素:
均为第二周期元素:①
 元素的原子核外共有
元素的原子核外共有②电离能
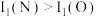 ,原因是
,原因是
您最近一年使用:0次
2024-01-06更新
|
370次组卷
|
3卷引用:吉林省辽源市田家炳高中友好学校七十六届期末联考2023-2024学年高二上学期1月期末化学试题
2 .  和
和 的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是
的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是
 和
和 的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是
的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是A.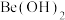 能与氨水反应生成 能与氨水反应生成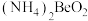 |
B. 和 和 均是共价化合物 均是共价化合物 |
C.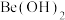 和 和 均是两性氢氧化物 均是两性氢氧化物 |
D. 溶液呈酸性 溶液呈酸性 |
您最近一年使用:0次
2023-03-30更新
|
260次组卷
|
5卷引用:吉林省长春市新解放学校2022-2023学年高二下学期4月月考化学试题
名校
解题方法
3 . 下列理论解释不符合实验事实的是
| 选项 | 实验事实 | 理论解释 |
| A | Be和Al都能溶于NaOH溶液 | Be和Al在元素周期表中是对角线关系,性质相似 |
| B | 酸性:H2SO4>H2SO3 | H2SO4中非羟基氧原子个数更多,中心原子的正电性更高 |
| C | Fe2+比Fe3+的稳定性小 | Fe2+和Fe3+的价电子排布式分别为3d6、3d5,Fe3+的3d能级为半充满的稳定结构 |
| D | SiO2的熔点高于CO2 | SiO2的相对分子质量更大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 运用元素周期律分析下面的推断,其中错误的是
①铍(Be)的最高价氧化物对应的水化物可能具有两性;②铊(Tl)位于周期表第六周期且与铝同族,其单质既能与盐酸反应产生氢气,又能与 溶液反应产生氢气;③砹(At)为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀硝酸;④锂溶于水生成一种强碱;⑤硫酸锶
溶液反应产生氢气;③砹(At)为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀硝酸;④锂溶于水生成一种强碱;⑤硫酸锶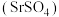 是难溶于水的白色固体;⑥硒化氢
是难溶于水的白色固体;⑥硒化氢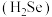 是无色、有毒、比
是无色、有毒、比 稳定的气体
稳定的气体
①铍(Be)的最高价氧化物对应的水化物可能具有两性;②铊(Tl)位于周期表第六周期且与铝同族,其单质既能与盐酸反应产生氢气,又能与
 溶液反应产生氢气;③砹(At)为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀硝酸;④锂溶于水生成一种强碱;⑤硫酸锶
溶液反应产生氢气;③砹(At)为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀硝酸;④锂溶于水生成一种强碱;⑤硫酸锶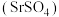 是难溶于水的白色固体;⑥硒化氢
是难溶于水的白色固体;⑥硒化氢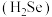 是无色、有毒、比
是无色、有毒、比 稳定的气体
稳定的气体| A.①②③④ | B.②④⑥ | C.①③⑤ | D.②④⑤ |
您最近一年使用:0次
2023-01-22更新
|
967次组卷
|
4卷引用:吉林省长春市东北师大附属中学2022-2023学年高一上学期期末考试化学试题
吉林省长春市东北师大附属中学2022-2023学年高一上学期期末考试化学试题吉林省东北师范大学附属中学2022-2023学年高一上学期1月期末考试化学试题(已下线)期末测试卷02-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册) 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末综合测试题(一)
名校
解题方法
5 . 元素周期表中,某些主族元素与右下方的主族元素(如图)的性质具有相似性,这种规律被称为“对角线规则”。则下列叙述错误的是
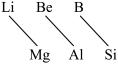

A. 受热分解生成 受热分解生成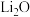 和 和 |
B.氧化铍的化学式为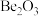 |
C.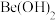 既能溶于强酸又能溶于强碱溶液 既能溶于强酸又能溶于强碱溶液 |
| D.类似硅酸钠溶液显碱性一样,硼酸钠溶液显碱性 |
您最近一年使用:0次
2022-12-24更新
|
381次组卷
|
4卷引用:吉林省长春市东北师范大学附属中学2022-2023学年高一上学期阶段考试化学试题
吉林省长春市东北师范大学附属中学2022-2023学年高一上学期阶段考试化学试题(已下线)【2023】【高一上】【源清中学】【期末考】【高中化学】【赵优萍收集】第2课时 元素周期表和元素周期律的应用(已下线)【定心卷】4.2.2 元素周期表和元素周期律的应用随堂练习-人教版2023-2024学年必修第一册
名校
6 . 下表为元素周期表的一部分, 请参照元素①~@在表中的位置,用化学用语作答:

(1)元素⑤、⑥、⑦、⑨的离子半径由大到小的顺序为_______________ (填离子符号) ;
(2)元素⑧、⑨、⑩的最高价含氧酸的酸性由强到弱的顺序为___________ (用化学式表示);
(3)写出⑥在空气中加热燃烧后产物的电子式:____________________ 。
(4)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式:__________________________ 。
(5)已知砷(As)为第VA族元素,位于元素⑧的下一周期,它的化合物可用于杀虫及医疗。
①As的原子结构示意图为________________ 。
②Y是由④⑥⑩三种元素组成的化合物,是生活中常见的消海剂。砷的氢化物可与Y的水溶液反应,生成砷的最高价含氧酸,则该反应的化学方程式为___________________ 。消耗l mol 还原剂时,转移电子的物质的量为_____________ mol。

(1)元素⑤、⑥、⑦、⑨的离子半径由大到小的顺序为
(2)元素⑧、⑨、⑩的最高价含氧酸的酸性由强到弱的顺序为
(3)写出⑥在空气中加热燃烧后产物的电子式:
(4)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式:
(5)已知砷(As)为第VA族元素,位于元素⑧的下一周期,它的化合物可用于杀虫及医疗。
①As的原子结构示意图为
②Y是由④⑥⑩三种元素组成的化合物,是生活中常见的消海剂。砷的氢化物可与Y的水溶液反应,生成砷的最高价含氧酸,则该反应的化学方程式为
您最近一年使用:0次
7 . 铍的性质类似于铝,下列有关铍性质和结构的推断正确的是
| A.铍与铝原子核外具有相同的未成对电子数 |
| B.氢氧化铍能与强酸、强碱溶液反应 |
| C.铍与铝元素具有相同的最高正化合价 |
| D.氧化铍只溶于强酸溶液,不溶于强碱溶液 |
您最近一年使用:0次
8 . 下表为元素周期表的一部分,其中的编号代表对应的元素。
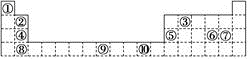
请回答下列问题:
(1)表中属于ds区的元素是________ (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状物结构简式为________ 。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子数为________ 。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:_______________________ 。
(5)画出⑨的外围电子排布图____________________________ .

请回答下列问题:
(1)表中属于ds区的元素是
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状物结构简式为
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子数为
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
(5)画出⑨的外围电子排布图
您最近一年使用:0次
9 . 硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼在元素周期表中的位置为_________ ,电子排布式是________ ,硼元素有两种天然同位素10B和11B,硼元素的近似相对原子质量为10.8,则两种同位素原子的原子个数之比为_______ 。
(2)单质硼(B)在一定条件下与NaOH溶液反应生成NaBO2和一种气体,请写出该反应的化学方程式________________ 。
(3)硼酸(H3BO3)是一种白色片状晶体,微溶于水,对人体的受伤组织有着和缓的防腐消毒作用。硼酸是一元弱酸,室温时0.1mol/L硼酸的pH为5,计算硼酸的电离常数K=__________ 。氟硼酸(HBF4)是一种强酸,仅以离子状态存在于水中,请写出BF4﹣的电子式__________ 。
(4)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。
①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构_________ (填“相同”或“不相同”)。
②B2H6可由BF3与NaBH4在一定条件下反应制得,写出该反应的化学方程式_________ 。
③B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为_________ L。
(1)硼在元素周期表中的位置为
(2)单质硼(B)在一定条件下与NaOH溶液反应生成NaBO2和一种气体,请写出该反应的化学方程式
(3)硼酸(H3BO3)是一种白色片状晶体,微溶于水,对人体的受伤组织有着和缓的防腐消毒作用。硼酸是一元弱酸,室温时0.1mol/L硼酸的pH为5,计算硼酸的电离常数K=
(4)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。
①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构
②B2H6可由BF3与NaBH4在一定条件下反应制得,写出该反应的化学方程式
③B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为
您最近一年使用:0次
2017-07-21更新
|
105次组卷
|
2卷引用:吉林省扶余一中2016-2017学年高二下学期期末考试化学试题
名校
10 . 铍元素性质与铝元素性质相似,下列方法能证明氯化铍由共价键构成的是( )
| A.溶于水加硝酸银溶液,观察是否有白色沉淀生成 |
| B.溶于水做导电实验,观察是否导电 |
| C.熔融状态,做导电实验,观察是否导电 |
| D.测定氯化铍熔点 |
您最近一年使用:0次
2017-03-30更新
|
193次组卷
|
5卷引用:吉林省辽源五中2017-2018学年高一下学期第一次月考化学试题
吉林省辽源五中2017-2018学年高一下学期第一次月考化学试题广西陆川县中学2016-2017学年高一下学期3月月考化学试题(已下线)《周末培优君》2017-2018学年高一下学期化学-第03周 化学键湖南省常德市石门县第二中学2018-2019学年高一下学期第一次月考化学试题广东省广州市南武中学2022-2023学年高一上学期期末考试化学试题



