1 . D、E、W、R、X、Y均为元素周期表前20号主族元素。根据所学知识,回答下列问题:
(1)化合物 是一种常见的干燥剂,其阳离子和阴离子的电子层结构相同,且
是一种常见的干燥剂,其阳离子和阴离子的电子层结构相同,且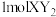 含有
含有 电子。则
电子。则 的化学式是
的化学式是_______ 。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是_______ ;D与E能形成一种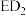 的三原子分子,且每个原子均达到了
的三原子分子,且每个原子均达到了 稳定结构,该分子的结构式为
稳定结构,该分子的结构式为_______ ,化学键类型为_______ (填“离子键”或“共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:加热时生成_______ ,其化学键类型为_______ ,电子式为_______ 。元素R是地壳中含量最多的金属元素,写出R的单质与Z的最高价氧化物对应水化物反应的离子方程式:_______ 。
(1)化合物
 是一种常见的干燥剂,其阳离子和阴离子的电子层结构相同,且
是一种常见的干燥剂,其阳离子和阴离子的电子层结构相同,且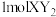 含有
含有 电子。则
电子。则 的化学式是
的化学式是(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是
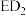 的三原子分子,且每个原子均达到了
的三原子分子,且每个原子均达到了 稳定结构,该分子的结构式为
稳定结构,该分子的结构式为(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:加热时生成
您最近一年使用:0次
解题方法
2 . 已知A、B、C、D、E、F是短周期的主族元素,且原子序数依次增大。A元素最外层电子数是次外层电子数的2倍。B元素的单质是空气的主要成分之一,它能形成多种氧化物,某些氧化物会造成光化学污染。C和D能形成电子总数为30和38的两种化合物。E与C同主族。F与G同主族,且G的单质在常温、常压下是有挥发性的深红棕色液体。请回答下列问题:
(1)元素B在元素周期表中的位置是_______ 。
(2)C、D、F三种元素形成的简单离子的半径由小到大的顺序是_______ (用离子符号回答)。
(3)C和D形成电子总数为38的化合物中化学键类型有_______ (填“离子键”或“共价键”);该化合物与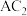 反应的化学方程式为
反应的化学方程式为_______ 。
(4)D元素的最高价氧化物对应的水化物的电子式为_______ ;其与 反应的离子方程式为
反应的离子方程式为_______ 。
(5)E和F两种元素相比较,元素原子的得电子能力较强的是_______ (填元素符号),可以验证该结论的是_______ (填序号)。
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的含氧酸的酸性
(6) 能使G单质的水溶液褪色,反应的化学方程式为
能使G单质的水溶液褪色,反应的化学方程式为_______ 。
(1)元素B在元素周期表中的位置是
(2)C、D、F三种元素形成的简单离子的半径由小到大的顺序是
(3)C和D形成电子总数为38的化合物中化学键类型有
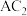 反应的化学方程式为
反应的化学方程式为(4)D元素的最高价氧化物对应的水化物的电子式为
 反应的离子方程式为
反应的离子方程式为(5)E和F两种元素相比较,元素原子的得电子能力较强的是
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的含氧酸的酸性
(6)
 能使G单质的水溶液褪色,反应的化学方程式为
能使G单质的水溶液褪色,反应的化学方程式为
您最近一年使用:0次
解题方法
3 . 如图是短周期主族元素电负性与第一电离能的关系。回答下列问题:
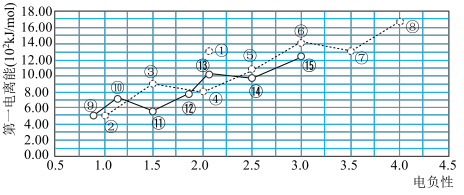
(1)元素③基态原子的电子排布式为___________ ;元素⑪的离子结构示意图为___________ 。
(2)元素①⑤⑧组成的18电子的化合物,其空间构型为___________ 。
(3)元素⑧⑨⑩⑭形成的简单离子,其离子半径由小到大的顺序为___________ (填离子符号),元素⑥⑫⑬形成的简单氢化物,熔沸点由低到高的顺序是___________ (填化学式)。
(4)实验室制备⑮单质的离子方程式为___________ 。
(5)我国研发的新能源汽车燃料电池工作原理如图所示,其中a为元素①与⑤形成的最简单化合物,b为元素⑦的单质,c为元素⑨的最高价氧化物对应水化物,反应后得到元素⑤的最高价含氧酸盐。则电极2上的电极反应式为___________ 。通入标准状况下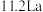 ,测得电路中转移
,测得电路中转移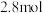 电子,则该电池电能的利用率为
电子,则该电池电能的利用率为___________ 。

(1)元素③基态原子的电子排布式为
(2)元素①⑤⑧组成的18电子的化合物,其空间构型为
(3)元素⑧⑨⑩⑭形成的简单离子,其离子半径由小到大的顺序为
(4)实验室制备⑮单质的离子方程式为
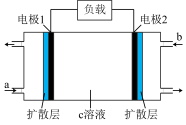
(5)我国研发的新能源汽车燃料电池工作原理如图所示,其中a为元素①与⑤形成的最简单化合物,b为元素⑦的单质,c为元素⑨的最高价氧化物对应水化物,反应后得到元素⑤的最高价含氧酸盐。则电极2上的电极反应式为
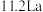 ,测得电路中转移
,测得电路中转移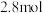 电子,则该电池电能的利用率为
电子,则该电池电能的利用率为
您最近一年使用:0次
名校
4 . Z、Y、X、W、Q为五种原子序数依次增大的短周期主族元素。其中Z、Y、W分别位于三个不同周期,Y、Q位于同一主族,Y原子的最外层电子数是W原子的最外层电子数的2倍,Y、X、W三种简单离子的核外电子排布相同。由Z、Y、X、W形成的某种化合物的结构如图所示。下列说法不正确 的是
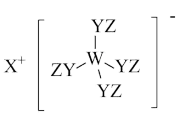
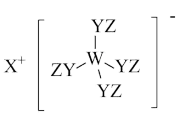
A.简单氢化物的稳定性: |
B.该物质中所有原子均满足最外层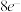 的稳定结构 的稳定结构 |
| C.X与Y、Y与Z均可形成含非极性共价键的化合物 |
| D.W与X两者的最高价氧化物对应的水化物之间可发生反应 |
您最近一年使用:0次
2022-01-25更新
|
882次组卷
|
8卷引用:浙江省宁波市九校2021-2022学年高一上学期期末联考化学试题
5 . 某分子结构式如图所示。其中,X的原子核只有1个质子,元素Y、M、N、W的原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。请用具体的化学用语回答下列问题:
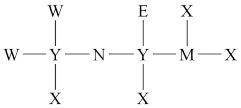
(1)Y在周期表中的位置是_______ , 的电子式为
的电子式为_______ 。
(2)含W的某种化合物的溶液常用来刻蚀玻璃,该化合物的化学式为_______ 。
(3)由X和Y形成的最简单的化合物的空间结构为_______ (填名称)。
(4)M的原子结构示意图为_______ 。由X、M、N三种元素形成的离子化合物的化学式为_______ 。
(5)实验室可用 、
、 分别与XE的浓溶液反应制备E单质,
分别与XE的浓溶液反应制备E单质, 与XE的浓溶液反应的化学方程式为
与XE的浓溶液反应的化学方程式为_______ 。若制备相同物质的量的E单质,消耗的 和
和 的物质的量之比为
的物质的量之比为_______ 。

(1)Y在周期表中的位置是
 的电子式为
的电子式为(2)含W的某种化合物的溶液常用来刻蚀玻璃,该化合物的化学式为
(3)由X和Y形成的最简单的化合物的空间结构为
(4)M的原子结构示意图为
(5)实验室可用
 、
、 分别与XE的浓溶液反应制备E单质,
分别与XE的浓溶液反应制备E单质, 与XE的浓溶液反应的化学方程式为
与XE的浓溶液反应的化学方程式为 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
6 . 短周期元素A、B、C、D的原子序数依次增加。X、Y、M、N为分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质。若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,N为一种常见的液体,上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中正确的是
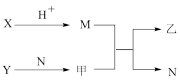

A.M、N分子的空间结构均为V形,且沸点: |
| B.X、Y中所含的化学键类型相同 |
C.四种元素的电负性大小顺序: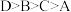 |
| D.D的最高价氧化物对应的水化物为强碱 |
您最近一年使用:0次
名校
解题方法
7 . 2020年某科研团队经多次实验发现一种新型漂白剂(结构见图),可用于漂白蚕丝等织品,其组成元素均为短周期元素,W、X对应的简单离子核外电子排布相同,且W、Y、Z的最外层电子数之和等于X的最外层电子数,下列说法错误的是
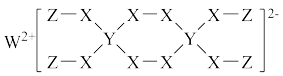

| A.四种元素中X的电负性最大 |
| B.该物质中各原子或离子均达到2或8电子稳定结构 |
| C.Y的最高价氧化物的水化物是一元弱酸 |
| D.离子半径:Z+ <X2- ˂W2+ |
您最近一年使用:0次
2021-11-06更新
|
430次组卷
|
3卷引用:湖北省华中师范大学第一附属中学2020-2021学年高一下学期期末考试化学试题
解题方法
8 . 化合物甲由两种常见的短周期元素组成,且所有原子均满足8电子稳定结构。某同学用分别 用5.15g甲进行如下两个实验:

其中,气体单质X的水溶液具有漂白性;甲和SO3按上述实验用量恰好完全反应生成乙和丙,其中乙由三种元素组成;混合气Y由两种常见酸性气体丙和丁组成,请回答:
(1)甲的化学式___________ 。
(2)X和丙同时通入水中时发生反应的离子方程式___________ 。
(3)乙和H2O反应生成混合气体Y的化学方程式___________ 。

其中,气体单质X的水溶液具有漂白性;甲和SO3按上述实验用量恰好完全反应生成乙和丙,其中乙由三种元素组成;混合气Y由两种常见酸性气体丙和丁组成,请回答:
(1)甲的化学式
(2)X和丙同时通入水中时发生反应的离子方程式
(3)乙和H2O反应生成混合气体Y的化学方程式
您最近一年使用:0次
名校
解题方法
9 . X、Y、Z、M为短周期元素,原子序数依次增大。A~J均由该四种元素构成的单质或化合物,其转化关系如图所示,部分生成物省略。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是___________ ;D的电子式是___________ 。
(2)请写出金属单质E在生产生活中的一种作用___________ 。
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是___________ ;B在制备过程中,气体A需要过量的理由是___________ 。
(4)写出F和G反应生成H和A的化学方程式是___________ 。
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)___________ 。
(6)写出J在已知②条件下受热分解的化学方程式是___________ 。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是
(2)请写出金属单质E在生产生活中的一种作用
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是
(4)写出F和G反应生成H和A的化学方程式是
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)
(6)写出J在已知②条件下受热分解的化学方程式是
您最近一年使用:0次
2021-11-05更新
|
1080次组卷
|
2卷引用:浙江省诸暨市2018-2019学年高二下学期期末考试化学试题
名校
解题方法
10 . 一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24.下列有关叙述错误的是
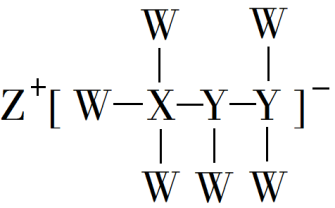
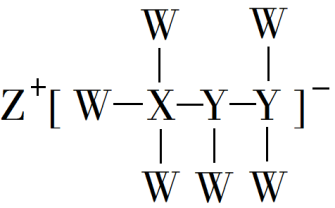
| A.该化合物中,W、X、Y之间均为共价键 |
| B.Z的单质能与水反应生成强碱 |
| C.Y的最高化合价氧化物的水化物为强酸 |
| D.X的氟化物XF3中原子均为8电子稳定结构 |
您最近一年使用:0次
2021-03-10更新
|
1557次组卷
|
4卷引用:广东省广州市三校2021-202学年高一上学期期末联考化学试题



