名校
1 . 表中①~⑥为短周期元素及相应部分原子半径的数据。下列说法正确的是
| 元素性质 | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 原子半径/nm | a | 0.075 | b | 0.110 | c | d |
| 最高化合价 | +6 | +5 | +5 | +7 | ||
| 最低化合价 | -2 | -3 | -2 | -3 | -1 | -1 |
| A.原子半径:a>d>b>c |
| B.元素①的最外层电子排布为2s22p4 |
| C.元素②氢化物与元素⑥氢化物反应形成化合物中只有价键 |
D.非金属性:元素⑤ 元素④ 元素④ 元素① 元素① |
您最近一年使用:0次
名校
2 . Z、Y、X、W、Q为五种原子序数依次增大的短周期主族元素。其中Z、Y、W分别位于三个不同周期,Y、Q位于同一主族,Y原子的最外层电子数是W原子的最外层电子数的2倍,Y、X、W三种简单离子的核外电子排布相同。由Z、Y、X、W形成的某种化合物的结构如图所示。下列说法不正确 的是
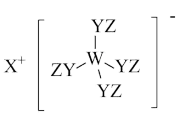
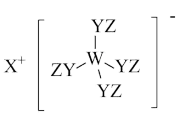
A.简单氢化物的稳定性: |
B.该物质中所有原子均满足最外层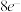 的稳定结构 的稳定结构 |
| C.X与Y、Y与Z均可形成含非极性共价键的化合物 |
| D.W与X两者的最高价氧化物对应的水化物之间可发生反应 |
您最近一年使用:0次
2022-01-25更新
|
914次组卷
|
8卷引用:浙江省宁波市九校2021-2022学年高一上学期期末联考化学试题
名校
3 . 重氮化合物是一类活泼的化合物,在有机合成方面有着重要应用。重氮化合物A在光照及甲醇参与反应的条件下经过一系列活泼中间体转化为F的路线如下:

回答下列问题:
(1)为研究反应历程,A中的一碳原子用13C标记,这种研究方法称为_______ 。
(2)B1中的一个碳原子含有未共用电子对,易与B2相互转化或转化为C,B2的官能团名称为_______ ;上述路线中与B1、B2互为同分异构体的是_______ (填标号);核磁共振氢谱、核磁共振碳谱都常用于分析有机化合物的结构,B1或B2的核磁共振碳谱有_______ 种碳原子的吸收峰。
(3)从结果上看,C和CH3OH生成E的反应类型为_______ ;写出CH2=C=O与CH3CH2OH反应的化学方程式_______ (不要求写出中间体)。
(4)E不稳定,能自发转化为F,说明稳定性C=O_______ C=C(填“大于”“小于”或“等于”),理由是_______ (从化学键的角度说明)。
(5)X、Y是二十多年前才发现的两种生物碱,在室温下可相互转化:

含N+的中间体的结构简式为_______ ;平衡时X、Y的物质的量之比n(X):n(Y)=3:2,则X转化为Y的平衡转化率为_______ 。

回答下列问题:
(1)为研究反应历程,A中的一碳原子用13C标记,这种研究方法称为
(2)B1中的一个碳原子含有未共用电子对,易与B2相互转化或转化为C,B2的官能团名称为
(3)从结果上看,C和CH3OH生成E的反应类型为
(4)E不稳定,能自发转化为F,说明稳定性C=O
(5)X、Y是二十多年前才发现的两种生物碱,在室温下可相互转化:

含N+的中间体的结构简式为
您最近一年使用:0次
2021-03-04更新
|
406次组卷
|
2卷引用:云南省昆明市第一中学2021届高三第六次复习检测理科综合化学试题
名校
4 . 化合物甲是一种常见无机物,其结构如下图所示(图中的“—”为单键或双键),其中W、X、Y、Z为元素周期表中的短周期主族元素,且原子序数依次增大,W和Y、X和Z分别为同主族元素,其四种元素原子的最外层电子数之和为14.下列叙述正确的是( )
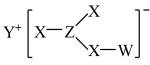
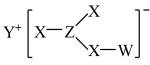
| A.W分别与X、Z形成的简单分子均为10电子微粒 |
| B.X、Y形成的离子化合物只含离子键 |
| C.X、Y、Z三种元素的简单离子半径大小顺序为Z>X>Y |
| D.等物质的量Y和Z的最高价氧化物对应的水化物反应生成甲 |
您最近一年使用:0次
2020-09-14更新
|
2895次组卷
|
12卷引用:天一大联考“顶尖计划”2021届高三第一次考试化学试题
天一大联考“顶尖计划”2021届高三第一次考试化学试题黑龙江省大庆实验中学2021届高三上学期第一次月考化学试题黑龙江省哈尔滨师范大学附属中学2021届高三10月月考化学试题(已下线)【南昌新东方】6 2020年10月江西南昌-江科附中-高三-上学期-月考化学卷四川省绵阳市涪城区绵阳南山中学2021届高三上学期11月月考理综化学试题重庆市第七中学2021届高三上学期期中化学试题(已下线)小题必刷22 元素周期表(律)及其应用——2021年高考化学一轮复习小题必刷(通用版)(已下线)练习13 共价键-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)湖南省长沙市长郡中学2021-2022学年高三下学期月考考试(第六次)化学试题河南省商丘市第一高级中学2021-2022学年高一下学期开学测试化学试题山东省临沂第一中学文峰校区2022-2023学年高一上学期期末考试化学试题江苏省沛县中学2022-2023学年高三上学期12月月考化学试题
名校
解题方法
5 . 氧、硫形成的化合物种类繁多,日常生活中应用广泛。如硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式如下:AgBr+2Na2S2O3===Na3[Ag(S2O3)2]+NaBr。回答下列问题:
(1)基态S的价电子排布图为____________ 。
(2)下列关于物质结构与性质的说法,正确的是________ 。
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测 的空间构型为
的空间构型为______ ,中心原子S的杂化方式为________ ,[Ag(S2O3)2]3-中存在的化学键有________ (填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因___________ 。
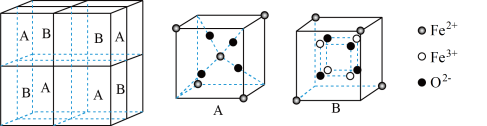
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B组成。则该氧化物的化学式为_____ ,已知该晶体的晶胞参数为a nm,阿伏加 德罗常数的值为NA,则密度ρ为______ g·cm-3(用含a和NA的代数式表示)。
(1)基态S的价电子排布图为
(2)下列关于物质结构与性质的说法,正确的是
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测
 的空间构型为
的空间构型为A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
| 元素 | Al | Si | P | S | Cl |
| E1/(kJ·mol-1) | 42.5 | 134 | 72.0 | 200 | 349 |
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B组成。则该氧化物的化学式为

您最近一年使用:0次
6 . 磷是人体所必需的重要矿物质元素,磷的化合物在生产和生活中应用广泛。
反应:P4+ NaOH+H2O→ NaH2PO2 +PH3(未配平)制得的次磷酸钠(NaH2PO2)可作食品防腐剂,也可用于化学镀镍。
请回答下列问题:
(1)磷原子的核外电子排布式:___________ ;磷原子核外有_____ 种能量不同的电子。
(2)上述反应的反应物和生成物中含有非极性键的分子是______ 。(写出物质的化学式)
(3)将Na、O、P三种原子的原子半径大小按由大到小的顺序排列___________________ 。
(4)NH3的稳定性比PH3的(填“强”或“弱”)_________ ,判断理由是____________ 。
(5)A、配平上述反应,并标出电子转移方向与数目_________
P4+ NaOH+ H2O→ NaH2PO2 + PH3
B、上述反应中每生成1 mol 氧化产物,转移电子的数目为___________ 。
反应:P4+ NaOH+H2O→ NaH2PO2 +PH3(未配平)制得的次磷酸钠(NaH2PO2)可作食品防腐剂,也可用于化学镀镍。
请回答下列问题:
(1)磷原子的核外电子排布式:
(2)上述反应的反应物和生成物中含有非极性键的分子是
(3)将Na、O、P三种原子的原子半径大小按由大到小的顺序排列
(4)NH3的稳定性比PH3的(填“强”或“弱”)
(5)A、配平上述反应,并标出电子转移方向与数目
P4+ NaOH+ H2O→ NaH2PO2 + PH3
B、上述反应中每生成1 mol 氧化产物,转移电子的数目为
您最近一年使用:0次
名校
解题方法
7 . X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,Y、Z间形成的某种化合物是一种常用的漂白剂、供氧剂,R和Z位于同一周期且基态原子中有3个电子能量最高,M2+与过量氨水作用先得到蓝色沉淀,后转化为深蓝色溶液Q。请回答下列问题:
(1)基态M2+的核外电子排布式为__ ,Y、Z、R、M四种元素的第一电离能由大到小的顺序为__ (用元素符号表示)。
(2)化合物XCl3的中心原子的杂化类型为__ ,RCl3的立体构型为__ ,XCl3、RCl3分子中属于非极性分子的是__ ;导致Q溶液显色的粒子中存在的化学键类型有__ 与配位键。
(3)已知H2Y2的熔点为-0.43℃、沸点为158℃,RH3的熔点为-133℃、沸点为-87.7℃,但H2Y2、RH3的相对分子质量相同,其主要原因是__ 。
(4)X、R两元素可形成一种具体立体网状结构的化合物,其晶胞结构如图所示。

①该化合物的晶体类型是__ ,该晶体的化学式为___ 。
②设两个X原子最近距离为apm,列式计算该晶胞的密度ρ=__ g·cm-3。
(1)基态M2+的核外电子排布式为
(2)化合物XCl3的中心原子的杂化类型为
(3)已知H2Y2的熔点为-0.43℃、沸点为158℃,RH3的熔点为-133℃、沸点为-87.7℃,但H2Y2、RH3的相对分子质量相同,其主要原因是
(4)X、R两元素可形成一种具体立体网状结构的化合物,其晶胞结构如图所示。

①该化合物的晶体类型是
②设两个X原子最近距离为apm,列式计算该晶胞的密度ρ=
您最近一年使用:0次
8 . W、N、X、Y、Z是原子序数依次增大的短周期主族元素。Y所处的周期序数与族序数相等。甲、乙、丙、丁、戊是由这些元素组成的化合物,丁是氯碱工业的-种产物,戊为二元化合物,常温下0.01 mol·L— 1戊溶液的pH为2。上述物质的转化关系如图所示。下列说法中错误的是

| A.原子半径: N<Y<X | B.W2N分子的比例模型为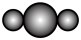 |
| C.物质丁中含有离子键和共价键 | D.丙在固态时属于分子晶体 |
您最近一年使用:0次
名校
解题方法
9 . A、B、C、X是中学化学常见的物质,A、B、C均由短周期元素组成,转化关系如图。
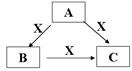
请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,向C的水溶液中通入过量的CO2可得B的白色胶状沉淀。
①A中含有的金属元素为_________ (写元素名称),它在周期表中的位置为_____________ 。
②写出B → C反应的离子方程式为___________________________________ 。
(2)若A为稀HNO3,X为常见黑色金属单质,写出A→B反应的离子方程式__________ 。
(3)若A、B、C三种化合物的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
①A中所含有的化学键是________________
②自然界中存在B、C和H2O按一定比例结晶而成的固体,取一定量该固体溶于水配成一定物质的量浓度的溶液100mL,所用到的玻璃仪器有玻璃棒、烧杯、________ 、_________ 。
③若测得上述溶液中金属阳离子的浓度为0.5mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为____________ g 。

请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,向C的水溶液中通入过量的CO2可得B的白色胶状沉淀。
①A中含有的金属元素为
②写出B → C反应的离子方程式为
(2)若A为稀HNO3,X为常见黑色金属单质,写出A→B反应的离子方程式
(3)若A、B、C三种化合物的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
①A中所含有的化学键是
②自然界中存在B、C和H2O按一定比例结晶而成的固体,取一定量该固体溶于水配成一定物质的量浓度的溶液100mL,所用到的玻璃仪器有玻璃棒、烧杯、
③若测得上述溶液中金属阳离子的浓度为0.5mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为
您最近一年使用:0次
11-12高二下·四川成都·阶段练习
解题方法
10 . A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1)X在周期表中的位置是_______
(2)化合物Y2X2的电子式为_______ ;它含有的化学键类型有 _______
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_______ 。
(4)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为_______ 。
(5)写出化合物Y2X2与水反应的离子方程式_______ 。
(6)B的最高价氧化物的结构式为_______ 。
(1)X在周期表中的位置是
(2)化合物Y2X2的电子式为
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为
(4)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为
(5)写出化合物Y2X2与水反应的离子方程式
(6)B的最高价氧化物的结构式为
您最近一年使用:0次



