名校
解题方法
1 . 2016年IUPAC确认了四种新元素,其中一种为Mc,中文名为“镆”元素Mc可由反应: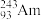 +
+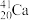 =
=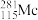 +3
+3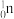 得到。
得到。
(1)该元素的质子数为___________ 。287Mc与288Mc互为________ 。
(2)Mc位于元素周期表中第ⅤA族,同族元素N的一种氢化物为H2N-NH2,写出该化合物分子的电子式:__________ ,该分子内存在的共价键类型有___________ 。
(3)该族中的另一元素P能呈现多种化合价,其中+3价氧化物的化学式为_______ ,+5价简单含氧酸的化学式为_________ 。
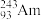 +
+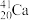 =
=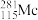 +3
+3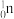 得到。
得到。(1)该元素的质子数为
(2)Mc位于元素周期表中第ⅤA族,同族元素N的一种氢化物为H2N-NH2,写出该化合物分子的电子式:
(3)该族中的另一元素P能呈现多种化合价,其中+3价氧化物的化学式为
您最近一年使用:0次
名校
2 . 有下列物质:① ;②
;② ;③
;③ ;④
;④ ;⑤
;⑤ ;⑥
;⑥ ;⑦
;⑦ 。
。
(1)上述物质中既含共价键又含离子键的是___________ (选填数字编号,下同);属于共价化合物的是___________ ;属于非极性分子的化合物是___________ 。
(2)④溶于水时破坏___________ ,固体⑦熔化时破坏___________ 。
A.离子键 B.共价键
 ;②
;② ;③
;③ ;④
;④ ;⑤
;⑤ ;⑥
;⑥ ;⑦
;⑦ 。
。(1)上述物质中既含共价键又含离子键的是
(2)④溶于水时破坏
A.离子键 B.共价键
您最近一年使用:0次
名校
3 . 随原子序数递增,八种短周期元素(用字母 等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
(1)f在周期表中的位置是_______ 。
(2) 、
、 两种元素的原子可构成一种碱性物质,该物质的电子式是
两种元素的原子可构成一种碱性物质,该物质的电子式是_______ 。
(3)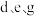 三者简单离子的半径由大到小顺序是(用离子符号表示):
三者简单离子的半径由大到小顺序是(用离子符号表示):_______ 。
(4)写出一个能证明 非金属性强弱的化学方程式:
非金属性强弱的化学方程式:_______ 。
(5)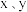 最简单化合物的空间构型为
最简单化合物的空间构型为_______ 。
(6)下列判断不正确的是_______。
 等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。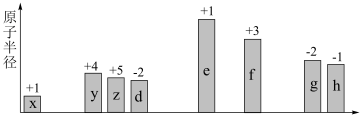
(1)f在周期表中的位置是
(2)
 、
、 两种元素的原子可构成一种碱性物质,该物质的电子式是
两种元素的原子可构成一种碱性物质,该物质的电子式是(3)
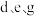 三者简单离子的半径由大到小顺序是(用离子符号表示):
三者简单离子的半径由大到小顺序是(用离子符号表示):(4)写出一个能证明
 非金属性强弱的化学方程式:
非金属性强弱的化学方程式:(5)
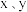 最简单化合物的空间构型为
最简单化合物的空间构型为(6)下列判断不正确的是_______。
A. 和 和 可以形成 可以形成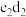 型化合物,正、负离子物质的量之比为 型化合物,正、负离子物质的量之比为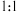 |
B.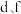 组成的化合物具有两性 组成的化合物具有两性 |
C. 的最高价氧化物对应水化物与 的最高价氧化物对应水化物与 的氢化物反应生成产物中既含有离子键又含有共价键 的氢化物反应生成产物中既含有离子键又含有共价键 |
D. 与 与 同主族,相差两个周期 同主族,相差两个周期 |
您最近一年使用:0次
名校
解题方法
4 . 为提高锂电池的充电速率,科学家最近研发了黑磷~石墨复合负极材料,其单层结构俯视图如图所示。石墨与黑磷制备该复合材料的过程,发生了___________ (选填“物理”或“化学”)变化,复合材料单层中,P原子与C原子之间的作用力是___________ (选填“离子键”或“共价键”)。
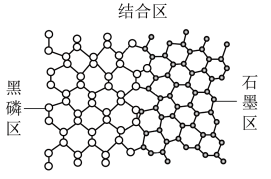
您最近一年使用:0次
名校
5 . 下列叙述正确的
A.区别 和葡萄糖的方法是熔融状态下能否导电 和葡萄糖的方法是熔融状态下能否导电 |
B. 中含有共价键,所以 中含有共价键,所以 属于共价化合物 属于共价化合物 |
| C.非金属元素组成的化合物中只含共价键 |
| D.某纯净物在常温常压下为气体,则组成该物质的微粒一定含共价键 |
您最近一年使用:0次
名校
解题方法
6 . 我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:SiO2+C+N2 Si3N4+CO;
Si3N4+CO;
(1)N2分子的结构式为___________ 。
(2)配平上述反应的化学方程式___________ 。
 Si3N4+CO;
Si3N4+CO;(1)N2分子的结构式为
(2)配平上述反应的化学方程式
您最近一年使用:0次
名校
解题方法
7 . 中国科学家成功合成了世界上首个“五氮负离子”的盐——(N5)6(H3O)3(NH4)4Cl。该固体盐中存在的化学键类型有___________ 。1mol“五氮负离子”中所含的电子数为___________ mol。
您最近一年使用:0次
8 . 水是清洁、可持续的氢能来源。利用太阳能从水中获取氢气符合可持续发展的理念。
“太阳能直接热分解水制氢”通过集中阳光产生2000K以上高温,促使H2O分解为H2和O2;若温度进一步升高至5000K,H2与O2会分解为气态原子。
(1)H2O分解过程中断裂的化学键属于
A.离子键 B.极性共价键 C.非极性共价键
(2)在相同条件下,同时存在如下两个过程:
ⅰ.2H(g)+O(g)=H2O(g)
ⅱ.H2(g)+ O2(g)=H2O(g)
O2(g)=H2O(g)
比较下列量的相对大小(均从选项中选择):①放出热量
A.ⅰ>ⅱ B.ⅰ=ⅱ C.ⅰ<ⅱ
您最近一年使用:0次
解题方法
9 . 钠元素在自然界中分布很广,储量极为丰富,都以化合态存在,如氯化钠、碳酸钠、硫酸钠等。钠单质和钠的化合物在生产、生活中被广泛应用。请根据钠及其化合物性质按要求完成各题。
(1)钠原子在周期表中的位置为___________ ,钠离子的结构示意图___________ 。
(2)请选择下列物质中合适的物质,按要求填空:
NaOH、 CaCl2 、 SO2 、H2O 、 NH4Cl
只含有离子键的有___________ (填化学式,下同),既含有离子键又含有共价键的有___________ ,只含共价键的有___________ 。
(3)钠的化学性质活泼,暴露在空气中生成___________ 色Na2O,在空气中加热,生成___________ 色的Na2O2,Na2O2可用作呼吸面具、潜水艇的供氧剂,写出Na2O2和CO2反应的化学方程式:___________ 。
(4)钠能在冷水中剧烈反应,该反应的实验现象中描述错误的是____。
(5)下列有关物质的性质描述正确的是____。
(6)Na2CO3和NaHCO3是常见的钠盐,且两者之间可以相互转化,请回答下列问题:
①下列有关碳酸钠和碳酸氢钠的说法正确的是____ 。
A.热稳定性:Na2CO3<NaHCO3
B.溶于水后,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
C.相同条件下,与同种酸反应的剧烈程度:Na2CO3<NaHCO3
D.石碱风化是物理过程
②写出Na2CO3在水溶液中的电离方程式___________ ;
③向Na2CO3溶液中通入CO2可生成NaHCO3,该反应的化学方程式为___________ ;
④加热15.0g碳酸钠和碳酸氢钠的固体混合物至质量不再发生变化,剩余固体的质量为11.9g,则混合物中碳酸氢钠的质量分数为____ 。
A.42% B.44% C.56% D.58%
(1)钠原子在周期表中的位置为
(2)请选择下列物质中合适的物质,按要求填空:
NaOH、 CaCl2 、 SO2 、H2O 、 NH4Cl
只含有离子键的有
(3)钠的化学性质活泼,暴露在空气中生成
(4)钠能在冷水中剧烈反应,该反应的实验现象中描述错误的是____。
| A.钠熔化成银白色小球 | B.钠在水面上迅速游动 |
| C.发出嘶嘶的声响 | D.溶液逐渐变红色 |
| A.钠与氧气反应时的产物主要取决于氧气的用量及纯度 |
| B.钠投入硫酸铜溶液中有气体和蓝色沉淀产生 |
| C.Na2O和Na2O2分别溶于水中,所得的产物相同 |
| D.FeCl3溶液用于铜质印刷线路制作,原因是两者发生置换反应 |
①下列有关碳酸钠和碳酸氢钠的说法正确的是
A.热稳定性:Na2CO3<NaHCO3
B.溶于水后,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
C.相同条件下,与同种酸反应的剧烈程度:Na2CO3<NaHCO3
D.石碱风化是物理过程
②写出Na2CO3在水溶液中的电离方程式
③向Na2CO3溶液中通入CO2可生成NaHCO3,该反应的化学方程式为
④加热15.0g碳酸钠和碳酸氢钠的固体混合物至质量不再发生变化,剩余固体的质量为11.9g,则混合物中碳酸氢钠的质量分数为
A.42% B.44% C.56% D.58%
您最近一年使用:0次
名校
解题方法
10 . 完成下列问题
(1)下列变化过程中有可能不涉及氧化还原反应的是_______
(2)氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用。下列叙述与氮元素的循环无关的是____
(3)关于新制饱和氯水,下列叙述正确的是_______
(4)下列实验中,能实现不同价态含硫物质的转化的是_______
(5)据文献报道,我国学者提出O2氧化HBr生成Br2的反应历程如图所示。下列有关该历程的说法错误的是_____

(6)高锰酸钾是生活中常用的一种消毒剂,也常被用于物质成分分析。二氧化锰是制取高锰酸钾的重要原料。制取高锰酸钾的方法是先用二氧化锰制取锰酸钾(K2MnO4),再转化为高锰酸钾。反应过程如下:
i.______MnO2+________KOH+____KClO3 ____K2MnO4+____KCl+____H2O
____K2MnO4+____KCl+____H2O
ii.3K2MnO4+4HCl=2KMnO4+4KCl+2H2O+MnO2
①下列反应中二氧化锰做氧化剂的是___________
a.实验室用氯酸钾和二氧化锰的混合物加热制取氧气
b.实验室用二氧化锰和浓盐酸混合加热制取氯气
c.用二氧化锰和铝混合发生铝热反应制取锰
d.用二氧化锰、氢氧化钾、氯酸钾共熔制取锰酸钾(K2MnO4)
②设计实验证明二氧化锰中含有哪种类型的化学键。(写出实验步骤、现象和结论)_________
③配平反应i的化学方程式_________ 。
④标出反应ii中电子转移的方向和数目_________ 。
⑤若工业上使用纯度为87%的软锰矿(主要成分为二氧化锰)制取高锰酸钾,理论上10吨软锰矿可制取高锰酸钾___________ 吨。
(1)下列变化过程中有可能不涉及氧化还原反应的是_______
| A.钝化 | B.漂白 | C.固氮 | D.燃烧 |
(2)氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用。下列叙述与氮元素的循环无关的是____
| A.工业合成氨的过程是固氮的过程 |
| B.自然界中,氨是动物体特别是蛋白质腐败后的产物 |
| C.为防止粮食、罐头、水果等食品腐烂,常用氮气作保护气 |
| D.在雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收 |
(3)关于新制饱和氯水,下列叙述正确的是_______
| A.加入适量NaOH,溶液黄绿色褪去,说明氯水中含有Cl2分子 |
| B.加入少量NaCl粉末,溶液漂白性增强 |
| C.加入少量的碳酸钠粉末,pH增大,溶液漂白性一定减弱 |
| D.光照过程中,有气泡冒出,溶液的导电性减弱 |
(4)下列实验中,能实现不同价态含硫物质的转化的是_______
| A.向含足量NaOH的Na2S溶液中加入Na2SO3 |
| B.常温下,向试管中加入1mL浓硫酸和一小块铜片 |
| C.将0.5g硫粉和1.0g铁粉均匀混合,在石棉网上用红热玻璃棒触及粉末一端至粉末红热 |
| D.向Na2SO3固体中加入70%的浓硫酸制备SO2 |
(5)据文献报道,我国学者提出O2氧化HBr生成Br2的反应历程如图所示。下列有关该历程的说法错误的是_____

| A.O2氧化HBr生成Br2的总反应为:O2+4HBr=2Br2+2H2O |
| B.中间体HOOBr和HOBr中Br的化合价相同 |
| C.发生步骤②时,断裂的化学键既有极性键又有非极性键 |
| D.步骤③中,每生成1molBr2转移2mol电子 |
(6)高锰酸钾是生活中常用的一种消毒剂,也常被用于物质成分分析。二氧化锰是制取高锰酸钾的重要原料。制取高锰酸钾的方法是先用二氧化锰制取锰酸钾(K2MnO4),再转化为高锰酸钾。反应过程如下:
i.______MnO2+________KOH+____KClO3
 ____K2MnO4+____KCl+____H2O
____K2MnO4+____KCl+____H2Oii.3K2MnO4+4HCl=2KMnO4+4KCl+2H2O+MnO2
①下列反应中二氧化锰做氧化剂的是
a.实验室用氯酸钾和二氧化锰的混合物加热制取氧气
b.实验室用二氧化锰和浓盐酸混合加热制取氯气
c.用二氧化锰和铝混合发生铝热反应制取锰
d.用二氧化锰、氢氧化钾、氯酸钾共熔制取锰酸钾(K2MnO4)
②设计实验证明二氧化锰中含有哪种类型的化学键。(写出实验步骤、现象和结论)
③配平反应i的化学方程式
④标出反应ii中电子转移的方向和数目
⑤若工业上使用纯度为87%的软锰矿(主要成分为二氧化锰)制取高锰酸钾,理论上10吨软锰矿可制取高锰酸钾
您最近一年使用:0次



