名校
解题方法
1 . 下列说法不正确的是
| A.离子化合物和金属单质的构成粒子中均含有阳离子 |
| B.离子键和金属键本质上都是静电作用,都没有方向性和饱和性 |
| C.熔点:MgO>NaCl>Hg>HBr |
| D.NaHSO4在水溶液中和熔融状态下都能导电,电离方程式相同 |
您最近一年使用:0次
2023-12-30更新
|
263次组卷
|
4卷引用:福建省三明市第一中学2023-2024学年高二下学期3月月考化学试题
福建省三明市第一中学2023-2024学年高二下学期3月月考化学试题北京市第一○一中学2021-2022学年高二下学期期末考试化学试卷(已下线)3.3.1 金属晶体 离子晶体(提高)(已下线)题型突破05 结构化学基本概念和图示题-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)
解题方法
2 . 计算机模拟催化剂表面水煤气产氢反应[ ]过程中能量的变化如图所示。下列说法错误的是
]过程中能量的变化如图所示。下列说法错误的是
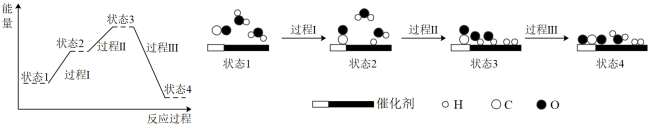
 ]过程中能量的变化如图所示。下列说法错误的是
]过程中能量的变化如图所示。下列说法错误的是
| A.过程Ⅰ、Ⅱ均需要吸收能量 | B.过程Ⅲ既有极性键又有非极性键形成 |
| C.该反应为放热反应 | D.由图可知 比 比 稳定 稳定 |
您最近一年使用:0次
3 . 汽车已成为现代社会的重要交通工具之一,化学物质在汽车的动力安全等方面有着极为重要的作用。回答下列问题:
I.
(1)某汽车安全气囊的气体发生剂主要含有 、
、 、
、 、
、 等物质。当汽车发生较严重的碰撞时,
等物质。当汽车发生较严重的碰撞时, 分解为Na和
分解为Na和 ,同时释放出大量的热,
,同时释放出大量的热, 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。
① 是助氧剂,其含有的化学键类型是
是助氧剂,其含有的化学键类型是________________________ 。
② 的作用为
的作用为__________________ 。
③汽车受到猛烈碰撞时,点火器点火引发 迅速分解,生成氢气和金属钠,同时释放大量的热,关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氢气和金属钠,同时释放大量的热,关于该反应过程中的能量变化示意图正确的是_______ (填字母)。
A.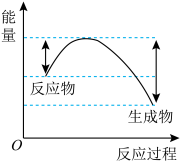 B.
B.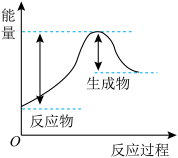 C.
C.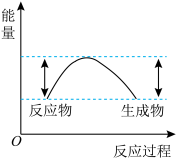
II.汽车尾气主要为 、CO、
、CO、 、NO等物质,是造成城市空气污染主要在因素之一。
、NO等物质,是造成城市空气污染主要在因素之一。
(2)科学家以 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
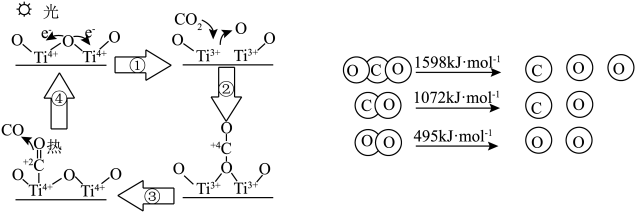
根据数据计算,分解2 mol 需吸收
需吸收_______ kJ的能量。
(3)一定条件下,用CO与NO反应生成 和
和 ,反应的化学方程式:
,反应的化学方程式:
 。
。
为提高该反应的速率,下列措施可行的是_______(填标号)。
(4)为了测定在催化剂作用下, 的反应速率,在某温度下用气体传感器测得不同时间的NO浓度如表:
的反应速率,在某温度下用气体传感器测得不同时间的NO浓度如表:
①前4 s内的平均反应速率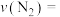
______ 。
②一定温度下,在固定容积的密闭容器中,通入1 mol CO和1 mol NO,在催化剂作用下发生反应。下列能作为反应达到平衡状态的依据的是______ (填序号)。
a.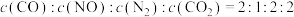
b.单位时间内生成2 mol CO,同时生成1 mol
c.NO的浓度与CO浓度相等
d.容器内总压强不再改变
e.单位时间内断裂1 mol的 键,同时生成2 mol的
键,同时生成2 mol的 键
键
I.
(1)某汽车安全气囊的气体发生剂主要含有
 、
、 、
、 、
、 等物质。当汽车发生较严重的碰撞时,
等物质。当汽车发生较严重的碰撞时, 分解为Na和
分解为Na和 ,同时释放出大量的热,
,同时释放出大量的热, 使气囊迅速膨胀,从而起到保护作用。
使气囊迅速膨胀,从而起到保护作用。①
 是助氧剂,其含有的化学键类型是
是助氧剂,其含有的化学键类型是②
 的作用为
的作用为③汽车受到猛烈碰撞时,点火器点火引发
 迅速分解,生成氢气和金属钠,同时释放大量的热,关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氢气和金属钠,同时释放大量的热,关于该反应过程中的能量变化示意图正确的是A.
 B.
B. C.
C.
II.汽车尾气主要为
 、CO、
、CO、 、NO等物质,是造成城市空气污染主要在因素之一。
、NO等物质,是造成城市空气污染主要在因素之一。(2)科学家以
 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
根据数据计算,分解2 mol
 需吸收
需吸收(3)一定条件下,用CO与NO反应生成
 和
和 ,反应的化学方程式:
,反应的化学方程式: 。
。为提高该反应的速率,下列措施可行的是_______(填标号)。
| A.扩大容器体积 | B.升高温度 | C.使用合适催化剂 | D.移出 |
 的反应速率,在某温度下用气体传感器测得不同时间的NO浓度如表:
的反应速率,在某温度下用气体传感器测得不同时间的NO浓度如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
 | 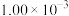 | 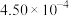 | 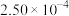 | 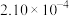 | 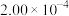 | 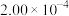 |
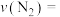
②一定温度下,在固定容积的密闭容器中,通入1 mol CO和1 mol NO,在催化剂作用下发生反应。下列能作为反应达到平衡状态的依据的是
a.
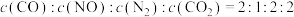
b.单位时间内生成2 mol CO,同时生成1 mol

c.NO的浓度与CO浓度相等
d.容器内总压强不再改变
e.单位时间内断裂1 mol的
 键,同时生成2 mol的
键,同时生成2 mol的 键
键
您最近一年使用:0次
名校
解题方法
4 . 用NaClO可除去水体中过量氨氮(以 表示),以防止水体富营养化。其原理如图所示。下列有关叙述正确的是
表示),以防止水体富营养化。其原理如图所示。下列有关叙述正确的是
 表示),以防止水体富营养化。其原理如图所示。下列有关叙述正确的是
表示),以防止水体富营养化。其原理如图所示。下列有关叙述正确的是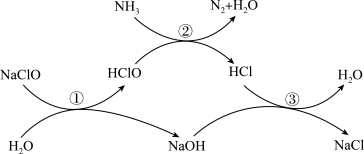
| A.原理中所涉及的元素的原子半径:Na>O>N>H |
B. 、 、 、 、 所含的质子数和电子数均相等 所含的质子数和电子数均相等 |
| C.NaClO和HClO所含的化学键类型相同 |
| D.反应③有离子键和共价键的断裂和形成 |
您最近一年使用:0次
2023-03-28更新
|
498次组卷
|
5卷引用:福建省三明第一中学2022-2023学年高一下学期期中考试化学(选考)试题
名校
解题方法
5 .  为乙二胺四乙酸
为乙二胺四乙酸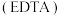 ,易与金属离子形成配合物。
,易与金属离子形成配合物。 为
为 与
与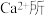 形成。下列叙述正确的是
形成。下列叙述正确的是

 为乙二胺四乙酸
为乙二胺四乙酸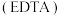 ,易与金属离子形成配合物。
,易与金属离子形成配合物。 为
为 与
与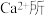 形成。下列叙述正确的是
形成。下列叙述正确的是
| A.b含有分子内氢键 | B.b中 的配位数为 的配位数为 |
C.a和b中的 原子均为 原子均为  杂化 杂化 | D.b含有共价键、离子键和配位键 |
您最近一年使用:0次
2023-02-17更新
|
401次组卷
|
11卷引用:福建省三明市第一中学2016-2017学年高二下学期半期考试化学试题
福建省三明市第一中学2016-2017学年高二下学期半期考试化学试题2015-2016学年福建省厦门市高二上学期期末质检化学试卷福建省厦门市湖滨中学2018-2019学年高二(理)上学期期中考试化学试题福建省厦门市思明区厦门外国语学校2019-2020学年高二上学期周末练习10——化学试题天津市耀华中学2020-2021学年高二下学期期中检测化学试题山西省朔州市怀仁市2020-2021学年高二下学期期末考试化学试题湖北省罗田县第一中学2021-2022学年高二下学期6月月考化学试题(实验班)湖北省当阳市第一高级中学2022-2023学年高三上学期期中考试化学试题(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(选择题11-13)江西省景德镇一中2022-2023学年高二下学期期中考试(19班)化学试题江西省宜春市宜丰中学2022-2023学年高三下学期3月月考化学试题
解题方法
6 . 1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
请仔细分析,回答下列有关问题:
(1)预测周期表中电负性最大的元素应为_______ ;估计钙元素的电负性的取值范围:_______ <X<_______ 。
(2)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为_______ 。
(3)请你预测Br与I元素的X数值的大小关系:X(Br)_______ X(I)。
(4)某有机化合物分子中含有S—N键,你认为该共用电子对偏向于_______ 原子(填元素符号)。
(5)根据表中的所给数据分析: 同主族内的不同元素的X值变化的规律是_______ ;
(6)化合物NaH能与水反应产生氢气,所以可用做生氢剂,写出该反应的化学方程式:_______ 。
(7)下列表述中,不能证明氯的非金属性比硫强的是_______ 。
A.气态氢化物的稳定性:HCl>H2S
B.两元素的电负性:S<Cl
C.最高价含氧酸的酸性:HClO4>H2SO4
D.常温时,硫单质为固态,氯单质为气态
E.两者间可发生反应:Cl2+H2S=2HCl+S↓
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(1)预测周期表中电负性最大的元素应为
(2)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为
(3)请你预测Br与I元素的X数值的大小关系:X(Br)
(4)某有机化合物分子中含有S—N键,你认为该共用电子对偏向于
(5)根据表中的所给数据分析: 同主族内的不同元素的X值变化的规律是
(6)化合物NaH能与水反应产生氢气,所以可用做生氢剂,写出该反应的化学方程式:
(7)下列表述中,不能证明氯的非金属性比硫强的是
A.气态氢化物的稳定性:HCl>H2S
B.两元素的电负性:S<Cl
C.最高价含氧酸的酸性:HClO4>H2SO4
D.常温时,硫单质为固态,氯单质为气态
E.两者间可发生反应:Cl2+H2S=2HCl+S↓
您最近一年使用:0次
名校
7 . Ⅰ.现有6种物质①MgCl2②HCl③SO2④K2CO3⑤CaO⑥NaHSO4⑦N2
请根据下列标准,对上述物质进行分类(填序号):
(1)属于共价化合物是___________ 。
(2)只含离子键的化合物是___________ 。
(3)含共价键的离子化合物是___________ 。
(4)如果将NaHSO4溶于水,破坏了NaHSO4中化学键的类型为___________ 。
Ⅱ.某温度时,在0.5L密闭容器中,某一反应中A、B气体的物质的量随时间变化的曲线如图所示,回答下列问题:
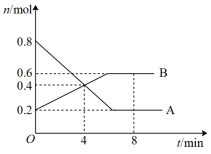
(1)该反应的化学方程式为___________ 。
(2)第4min时,正、逆反应速率的大小关系为:v(正)___________ v(逆),(填“>”“<”或“=”)。
(3)下列措施能加快反应速率的是___________ 。
A.恒温恒容充入He气B.缩小体积,使压强增大
C.恒温恒压充入He气D.使用催化剂
请根据下列标准,对上述物质进行分类(填序号):
(1)属于共价化合物是
(2)只含离子键的化合物是
(3)含共价键的离子化合物是
(4)如果将NaHSO4溶于水,破坏了NaHSO4中化学键的类型为
Ⅱ.某温度时,在0.5L密闭容器中,某一反应中A、B气体的物质的量随时间变化的曲线如图所示,回答下列问题:

(1)该反应的化学方程式为
(2)第4min时,正、逆反应速率的大小关系为:v(正)
(3)下列措施能加快反应速率的是
A.恒温恒容充入He气B.缩小体积,使压强增大
C.恒温恒压充入He气D.使用催化剂
您最近一年使用:0次
名校
解题方法
8 . 如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。下列判断不正确的是
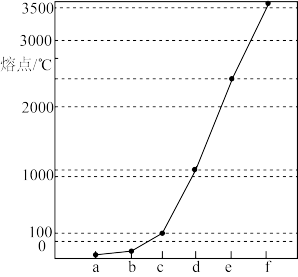

| A.图中对应的e、f单质晶体熔化时克服的是共价键 |
| B.第二电离能:c>d |
| C.b元素形成的最高价含氧酸易与水分子之间形成氢键 |
| D.单质a、b、f对应的元素以原子个数比1∶1∶1形成的最简单分子中含2个σ键和2个π键 |
您最近一年使用:0次
名校
9 . 利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )
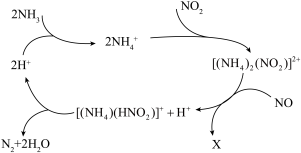

| A.X是N2 |
B.NH 中含有非极性共价键 中含有非极性共价键 |
C.NH3、NH 、H2O中的质子数、电子数均相同 、H2O中的质子数、电子数均相同 |
D.上述历程的总反应为:2NH3+NO+NO2 2N2+3H2O 2N2+3H2O |
您最近一年使用:0次
2020-07-03更新
|
472次组卷
|
5卷引用:福建省三明市五县联合质检2022-2023学年高一下学期期中考试化学试题
10-11高一下·山西临汾·期中
名校
解题方法
10 . 下列每组物质中含有的化学键类型相同的是
A. 、 、 、 、 、 、 |
B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 |
D. 、 、 、 、 、 、 |
您最近一年使用:0次
2020-03-02更新
|
546次组卷
|
43卷引用:福建省尤溪县第七中学2022-2023学年高一下学期第一次阶段检测化学试题
福建省尤溪县第七中学2022-2023学年高一下学期第一次阶段检测化学试题(已下线)2010-2011学年山西省临汾一中高一下学期期中考试化学试卷(已下线)2011-2012学年广东省梅州市曾宪梓中学高一中段考试化学试卷(已下线)2011-2012学年陕西省宁强县天津高级中学高一下学期期中化学试卷(已下线)2011-2012学年贵州省盘县二中高一下学期期中考试化学试卷2016届黑龙江哈尔滨师大附中高三上学期期中考试化学试卷2015-2016学年河北省秦皇岛市卢龙县高一下学期期中考试化学试卷2016-2017学年河北省邯郸一中高二上开学测化学试卷2016-2017学年湖北省襄阳五中高二上10月月考化学试卷2017届黑龙江双鸭山一中高三上学期期中化学试卷2016-2017学年湖北省枣阳市高一下学期第一次质量检测化学试卷2016-2017学年山西省太原市外国语学校高一下学期第一次月考化学试卷2016-2017学年河北省邯郸市大名县第一中学高一3月月考化学试卷河北省馆陶县第一中学2016-2017学年高二下学期期中考试化学试题吉林省实验中学2016-2017学年高一下学期期中考试(文)化学试题安徽省蚌埠市第二中学2017-2018学年高二8月月考化学试题(已下线)二轮复习 专题7 物质结构与元素周期律 押题专练宁夏银川一中2017-2018学年高一下学期期中考试化学试题云南省石屏县一中2017-2018学年高一下学期六月份月考化学试题【全国校级联考】贵州省铜仁市西片区高中教育联盟2017-2018学年高二下学期期末考试化学试题(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(押题专练)(已下线)2019年3月5日 《每日一题》人教必修2-共价键和共价化合物(已下线)第06天 化学键的相关概念——《2019年暑假作业总动员》高二化学海南省临高县临高中学2019-2020学年高一上学期期末考试化学试题第三节 化学键第二单元微粒之间的相互作用力河北省保定市第三中学2019-2020学年高一下学期期中考试化学试题(已下线)5.2.2 共价键 分子间作用力练习(2)——《高中新教材同步备课》(苏教版 必修第一册)人教版(2019)高一必修第一册第四章 物质结构 元素周期律 第三节 化学键高一必修第一册(苏教2019版)专题5 第二单元 微粒之间的相互作用力(已下线)课时27 微粒间作用力-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点06 原子结构 化学键-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间作用力-备战2022年高考化学一轮复习考点帮(浙江专用)河南省新野县第一高级中学校2021-2022学年高一下学期第三次考试化学试题陕西省西安中学2021-2022学年高一下学期期中考试化学试题陕西省西安中学2021-2022学年高一下学期期中考试化学试题四川省内江市第六中学2021-2022学年高一下学期期中考试化学试题河南省郑州市第四高级中学2021-2022学年高一下学期第三次调研考试化学试题(已下线)第11练 化学键-2023年高考化学一轮复习小题多维练(全国通用)福建省长泰第二中学2021-2022学年高一下学期第一次月考化学试题宁夏贺兰景博中学2021-2022学年高一下学期第一次月考化学试题福建省诏安县桥东中学2021-2022学年高一下学期期中考试化学试题福建省南平市高级中学2022-2023学年高一下学期期中考试化学试题



