解题方法
1 . 下列关于价电子构型为3s23p4的粒子描述正确的是( )
| A.它的原子核外有三种形状不同的电子云 |
| B.它的原子核外电子共有16种不同的运动状态 |
| C.它可与H2反应生成的化合物为非极性分子 |
D.核外电子轨道表示式为: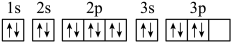 |
您最近一年使用:0次
解题方法
2 . 下列叙述正确的是
| A.若以E表示某能级的能量,则E(4s)>E(3d)>E(2s) |
| B.当电子排布在同一能级的不同轨道时,总是优先独自占据一个轨道,且自旋状态相反 |
| C.氢原子的基态电子的概率分布图中,小黑点的疏密程度表示电子在该区域出现的概率大小 |
| D.任一电子层的能级总是从s能级开始,f能级结束 |
您最近一年使用:0次
名校
解题方法
3 . 下列叙述中,正确的是
| A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 |
| B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子 |
| C.如果某一基态原子3p轨道上仅有2个电子,它们自旋方向必然相反 |
| D.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高 |
您最近一年使用:0次
2020-01-07更新
|
73次组卷
|
6卷引用:2020届高三化学选修三二轮专题复习——原子核外运动的特点
4 . 下列叙述不正确的是
A. 图是最密堆积,在俯视图中是一、三、五 图是最密堆积,在俯视图中是一、三、五 各层球心重合,二、四、六 各层球心重合,二、四、六 各层球心重合 各层球心重合 |
B.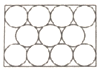 图为密置层,配位数为6 图为密置层,配位数为6 |
C. H原子的电子云图如图所示,H原子核外大多数电子在原子核附近运动 H原子的电子云图如图所示,H原子核外大多数电子在原子核附近运动 |
D.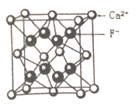 图是CaF2晶胞的结构,其中F-在Ca2+构成的正四面体中心 图是CaF2晶胞的结构,其中F-在Ca2+构成的正四面体中心 |
您最近一年使用:0次
5 . 下列有关说法不正确的是
A.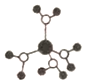 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键 |
B. 图是一种金属晶体的晶胞,它是金属原子在三维空间以密置层采取 图是一种金属晶体的晶胞,它是金属原子在三维空间以密置层采取  堆积的结果 堆积的结果 |
C. 石墨的片层结构如图所示,在片层结构中,碳原子数、六元环数之比为2:1 石墨的片层结构如图所示,在片层结构中,碳原子数、六元环数之比为2:1 |
D. H原子的电子云图如图所示,H原子核外大多数电子在原子核附近运动 H原子的电子云图如图所示,H原子核外大多数电子在原子核附近运动 |
您最近一年使用:0次
6 . 下列有关说法不正确的是
A.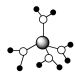 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键 |
B.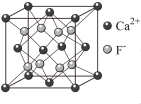 CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+ CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+ |
C. H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动 H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动 |
D. 金属Ag的原子堆积模型如图所示,该金属晶体为最密堆积,每个Ag原子的配位数均为12 金属Ag的原子堆积模型如图所示,该金属晶体为最密堆积,每个Ag原子的配位数均为12 |
您最近一年使用:0次
2020-01-07更新
|
149次组卷
|
3卷引用:2020届高三化学二轮物质结构题型专攻—— 均摊法及晶体的相关计算【选择专练】
7 . 铬镍基合金的性质稳定,抗高温燃气腐蚀能力强,广泛应用于舰船和工业的燃气轮机。某种铬镍基合金由Fe、Cr、Ni、C四种元素组成。
(1)Fe、Cr、Ni的基态原子核外电子占据的最高能层为________  填符号
填符号 。
。
(2)基态Cr原子价层电子的电子排布式为________ ,与Cr同周期且基态原子最外层电子数相同的元素,位于周期表的________ 区。
(3)Fe3+与SCN-反应生成红色的K3Fe(SCN)6,K3Fe(SCN)6内部的作用力有________ 。写出一种与SCN-互为等电子体的分子的化学式________ 。
(4)已知FeO、NiO的晶体结构均为NaCl型,且NiO的熔点高于FeO,其理由是________ 。
(5)C60分子结构及其晶胞结构如图1和图2所示。若在C60晶体的空隙中插入K+,该晶体在一定条件下具有超导能力,其结构如图3所示。

(1)Fe、Cr、Ni的基态原子核外电子占据的最高能层为
 填符号
填符号 。
。(2)基态Cr原子价层电子的电子排布式为
(3)Fe3+与SCN-反应生成红色的K3Fe(SCN)6,K3Fe(SCN)6内部的作用力有
(4)已知FeO、NiO的晶体结构均为NaCl型,且NiO的熔点高于FeO,其理由是
(5)C60分子结构及其晶胞结构如图1和图2所示。若在C60晶体的空隙中插入K+,该晶体在一定条件下具有超导能力,其结构如图3所示。

您最近一年使用:0次
8 . 镁、铝、铁是三种重要金属,它们的单质和化合物应用十分广泛。回答下列问题:
(1)镁、铝第一电离能大小的关系是I1(Mg)_________ I1(Al),金属镁、铝熔点大小关系是Mg_________ Al。(填“大于”、“等于”或“小于”)
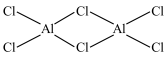
(2)氯化铝加热时易升华,实验测得铝元素与氯元素形成化合物的实际组成为Al2Cl6,其结构简式如图所示。其中处于中间的Al原子杂化轨道类型为_________ 杂化,分子中所有原子_________ (能、不能)在同一平面上。
(3)硝酸铁和尿素在乙醇中生成[Fe(H2NCONH2)6](NO3)3三硝酸六尿素合铁 。产物是一种重要的配合物,用作有机铁肥,简称铁氮肥。基态Fe3+的核外电子排布式为
。产物是一种重要的配合物,用作有机铁肥,简称铁氮肥。基态Fe3+的核外电子排布式为____________ 。尿素分子中 键与
键与 键的数目之比为
键的数目之比为_______ 。NO3-的空间构型为_________ ,经测定N2O5晶体中存在NO2+和NO3-,NO2+中氮原子为_________ 杂化。
(4)碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示。晶体中与相邻铁原子距离相等且最近的铁原子有________ 个,该物质的化学式为_________ 。若晶体密度为dg/cm3,则晶胞中最近的两个碳原子的距离为___________ pm(阿伏加 德罗常数的值为NA表示,写出简化后的计算式即可)。

(1)镁、铝第一电离能大小的关系是I1(Mg)
(2)氯化铝加热时易升华,实验测得铝元素与氯元素形成化合物的实际组成为Al2Cl6,其结构简式如图所示。其中处于中间的Al原子杂化轨道类型为

(3)硝酸铁和尿素在乙醇中生成[Fe(H2NCONH2)6](NO3)3三硝酸六尿素合铁
 。产物是一种重要的配合物,用作有机铁肥,简称铁氮肥。基态Fe3+的核外电子排布式为
。产物是一种重要的配合物,用作有机铁肥,简称铁氮肥。基态Fe3+的核外电子排布式为 键与
键与 键的数目之比为
键的数目之比为(4)碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示。晶体中与相邻铁原子距离相等且最近的铁原子有

您最近一年使用:0次
2020-01-07更新
|
147次组卷
|
2卷引用:2020届高三化学选修三二轮专题复习——晶体的缺陷及其应用
名校
9 . 符号“2p”没有给出的信息是( )
| A.能级 | B.电子层 |
| C.电子亚层 | D.电子云在空间的伸展方向 |
您最近一年使用:0次
2019-12-29更新
|
270次组卷
|
5卷引用:2019-2020学年上海各区(16区)高三化学一模选择题汇编-物质的组成与结构
名校
解题方法
10 . 含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为_____ ;基态Cu+的核外电子排布式为_____ 。
(2)化合物(CH3)3N分子中N原子杂化方式为_____ ,该物质能溶于水的原因是_____ 。
(3)PH3分子的键角小于NH3分子的原因是_____ ;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为_____ 。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:
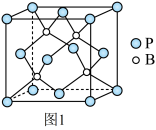
①在一个晶胞中磷原子的配位数为_____ 。
②已知磷化硼晶体的密度为ρg/cm3,阿伏加 德罗常数为NA,则B-P键长为_____ 。
(1)基态B原子电子占据最高能级的电子云轮廓图为
(2)化合物(CH3)3N分子中N原子杂化方式为
(3)PH3分子的键角小于NH3分子的原因是
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:

①在一个晶胞中磷原子的配位数为
②已知磷化硼晶体的密度为ρg/cm3,阿伏加 德罗常数为NA,则B-P键长为
您最近一年使用:0次



