解题方法
1 . 下列化学用语错误的是
A.邻羟基苯甲醛的分子内氢键: |
B. 的电子式: 的电子式: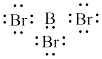 |
C. 空间结构模型: 空间结构模型: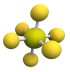 |
D.基态O原子核外电子占据最高能级的电子云轮廓图: |
您最近一年使用:0次
2 . 核能是一种可持续的新兴能源,但也有潜在的风险。我国科学家最近合成了一种能够高效捕获与储存核泄漏产生的放射性碘的物质,合成原料之一结构如图所示,X、Y、Z、W的原子序数依次增大、分列三个短周期的主族元素,其中,Z的单质是组成空气的主要成分。下列说法正确的是

A.原子半径: |
B.最简单氢化物的稳定性: |
C.电负性: |
| D.W的基态原子有9种空间运动状态不同的电子 |
您最近一年使用:0次
名校
3 . 化学用语可以表达化学过程。下列化学用语的表达正确的是
A.用电子式表示 的形成: 的形成: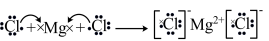 |
B.用化学方程式表示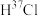 与 与 按 按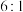 反应: 反应: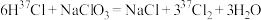 |
C.用离子方程式表示向 溶液中加入少量的 溶液中加入少量的 溶液: 溶液: |
D.用电子云轮廓图表示 的 的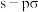 键形成的示意图: 键形成的示意图: |
您最近一年使用:0次
2024-02-10更新
|
298次组卷
|
3卷引用:安徽师范大学附属中学2024届高三1月月考化学试卷
4 . 侯德榜联合制碱法的原理之一是NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓。下列关于该原理中涉及到的微粒的叙述正确的是
A.NH3的VSEPR模型为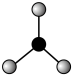 |
| B.基态钠离子的电子排布式:1s22s22p63s1 |
C.NaCl的形成过程: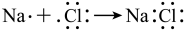 |
D.O元素2pz电子云图为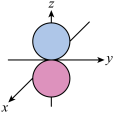 |
您最近一年使用:0次
解题方法
5 . 主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,从该矿渣中回收六水合硫酸镍晶体的工艺流程如图:

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。
(1)28Ni位于元素周期表_____ 区(填“s”“p”“d”或“ds”),其基态原子核外电子的空间运动状态有_____ 种。
(2)“焙烧”中,SiO2几乎不发生反应,NiO、CaO、FeO转化为相应的硫酸盐。NiFe2O4生成NiSO4、Fe2(SO4)3,发生该反应的化学方程式为______ 。
(3)“浸渣”的成分除Fe2O3、FeO(OH)外还含有______ (填化学式),为检验浸出液中是否含有Fe3+,可选用的化学试剂是______ 。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol•L-1,加NaF固体时,忽略溶液体积变化,当除钙率达到99%时,除钙后的溶液中c(F-)=______ 。[已知Ksp(CaF2)=4.0×10-11]
(5)“萃取”时发生反应Mn+(水相)+nRH(有机相) MRn(有机相)+nH+(水相)(Mn+为金属离子,RH为萃取剂),萃取率与
MRn(有机相)+nH+(水相)(Mn+为金属离子,RH为萃取剂),萃取率与 的关系如图所示,V0/VA的最佳取值为
的关系如图所示,V0/VA的最佳取值为______ ;“反萃取”能使有机相再生而循环使用,可在有机相中加入______ ,待充分反应后再分液。

(6)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
从NiSO4溶液获得稳定的NiSO4•H2O晶体的操作是:______ 、______ 、过滤、洗涤、干燥等多步操作。

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。
(1)28Ni位于元素周期表
(2)“焙烧”中,SiO2几乎不发生反应,NiO、CaO、FeO转化为相应的硫酸盐。NiFe2O4生成NiSO4、Fe2(SO4)3,发生该反应的化学方程式为
(3)“浸渣”的成分除Fe2O3、FeO(OH)外还含有
(4)“浸出液”中c(Ca2+)=1.0×10-3mol•L-1,加NaF固体时,忽略溶液体积变化,当除钙率达到99%时,除钙后的溶液中c(F-)=
(5)“萃取”时发生反应Mn+(水相)+nRH(有机相)
 MRn(有机相)+nH+(水相)(Mn+为金属离子,RH为萃取剂),萃取率与
MRn(有机相)+nH+(水相)(Mn+为金属离子,RH为萃取剂),萃取率与 的关系如图所示,V0/VA的最佳取值为
的关系如图所示,V0/VA的最佳取值为
(6)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
| 温度 | 低于30.8℃ | 30.8~53.8℃ | 53.8~280℃ | 高于280℃ |
| 晶体形态 | NiSO4•7H2O | NiSO4•H2O | 多种结晶水合物 | NiSO4 |
您最近一年使用:0次
解题方法
6 . 元素H、N、O、S、Ni、Fe之间可形成多种化合物。请回答下列问题:
(1)基态Fe2+原子的价电子排布式为____________ ;Fe原子最外层电子的电子云形状为__________ 。
(2)N、O、S三种元素的第一电离能由大到小的顺序为___________ ;下列状态的O中,最容易失去最外层电子的是___________ (填字母)。
A.1s22s22p3 B.1s22s22p4 C.1s22s22p33s1 D.1s22s22p23s1
(3)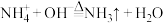 ,
, 转化为NH3的过程中,没有发生变化的有
转化为NH3的过程中,没有发生变化的有________ (填字母)。
A.键角 B.粒子的空间构型 C.杂化轨道类型
(4)已知单质铁有如图所示的三种堆积方式的晶胞结构:

①若晶胞a中Fe原子直径为d pm,设该晶胞边长x,则x=_________ cm。(用含d的代数式表示)。
②晶胞b中与一个Fe原子最邻近的Fe原子共有_________ 个。
③若晶胞c的密度为ρ g/cm3,则铁的原子半径r=_________ cm。(NA表示阿伏加德罗常数的值,用含ρ、NA的式子表示)。
(1)基态Fe2+原子的价电子排布式为
(2)N、O、S三种元素的第一电离能由大到小的顺序为
A.1s22s22p3 B.1s22s22p4 C.1s22s22p33s1 D.1s22s22p23s1
(3)
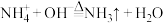 ,
, 转化为NH3的过程中,没有发生变化的有
转化为NH3的过程中,没有发生变化的有A.键角 B.粒子的空间构型 C.杂化轨道类型
(4)已知单质铁有如图所示的三种堆积方式的晶胞结构:

①若晶胞a中Fe原子直径为d pm,设该晶胞边长x,则x=
②晶胞b中与一个Fe原子最邻近的Fe原子共有
③若晶胞c的密度为ρ g/cm3,则铁的原子半径r=
您最近一年使用:0次
名校
解题方法
7 . KZnF3是一种良好的光学材料,可由K2CO3、ZnF2、NH4HF2制备,掺杂Co、Ni等过渡金属可得到不同的荧光材料,回答下列问题:
(1)基态F原子的价电子轨道表达式为___ ;基态Zn原子核外占据最高能层电子的电子云轮廓图形状为___ 。
(2)K2CO3中阴离子的立体构型为___ ,NH4HF2中N原子的杂化方式为___ 。
(3)某镍配合物结构如图所示。
①分子内含有的化学键有___ (填序号)。
②配合物中元素原子的第一电离能N___ O(填“>”“<”或“=”),从原子结构角度解释原因是___ 。
(4)KZnF3具有钙钛矿型立方结构,其晶胞结构如图所示:___ 。
②已知晶胞边长为a pm,NA表示阿伏加德罗常数的值,则KZnF3晶体的密度为___ g·cm-3(用含a、NA的代数式表示)。
(1)基态F原子的价电子轨道表达式为
(2)K2CO3中阴离子的立体构型为
(3)某镍配合物结构如图所示。
①分子内含有的化学键有
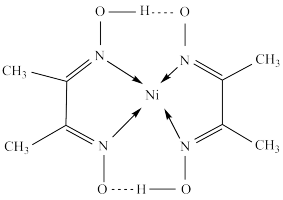
②配合物中元素原子的第一电离能N
(4)KZnF3具有钙钛矿型立方结构,其晶胞结构如图所示:
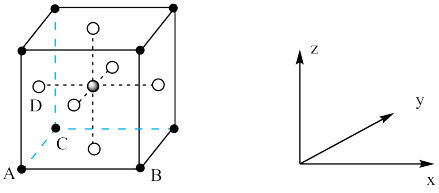
②已知晶胞边长为a pm,NA表示阿伏加德罗常数的值,则KZnF3晶体的密度为
您最近一年使用:0次
2021-09-04更新
|
761次组卷
|
5卷引用:安徽省蚌埠市2022届高三上学期第一次教学质量检查化学试题
8 . (1)写出碳原子最外电子层的轨道表示式___ 。
(2)钛(Ti)是22号元素,它是___ (选填编号)
a.主族元素 b.副族元素 c.短周期元素 d.长周期元素
(3)CS2分子的电子式为____ ;其熔沸点比CO2高的原因是___ 。
(4)氟化钠溶液中,不存在的微粒间作用力是___ (填标号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(5)金属铜单独与氨水或过氧化氢均不能反应,但可与过氧化氢和过量氨水的混合溶液反应生成一种配位化合物,其反应的化学方程式可表示为_____ 。
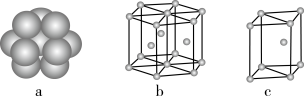
(6)镁单质晶体中原子的堆积模型为六方最密堆积(如图),它的晶胞是图中的___ (填a、b或c);配位数是____ ;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2acm3,镁单质的密度为ρg•cm-3,已知阿伏加 德罗常数为NA,则镁的摩尔质量的计算式是__ 。
(2)钛(Ti)是22号元素,它是
a.主族元素 b.副族元素 c.短周期元素 d.长周期元素
(3)CS2分子的电子式为
(4)氟化钠溶液中,不存在的微粒间作用力是
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(5)金属铜单独与氨水或过氧化氢均不能反应,但可与过氧化氢和过量氨水的混合溶液反应生成一种配位化合物,其反应的化学方程式可表示为

(6)镁单质晶体中原子的堆积模型为六方最密堆积(如图),它的晶胞是图中的
您最近一年使用:0次
解题方法
9 . 镓(31Ga)是一种重要金属元素,镓及其化合物在电子工业、光电子工业、国防工业和超导材料等领域有着广泛的应用。回答下列问题:
(1)基态Ga原子占据最高能级电子的电子云轮廓图形状为__________ ,未成对电子数为________________ 。
(2)Ga(NO3)3中阴离子的立体构型是_____________ ,写出一个与该阴离子的立体构型相同的分子的化学式___________ 。
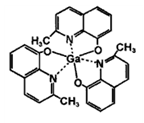
(3)2-甲基-8-羟基喹啉镓(如图)应用于分子印迹技术,2-甲基-8-羟基喹啉镓中五种元素电负性由大到小的顺序是____________________________ (填元素符号),提供孤电子对的成键原子是_____________ 。
(4)一种硅镓半导体材料的晶胞结构如图所示由硫、镓、银形成的化合物的晶胞是底面为正方形的长方体,结构如下图所示,则该晶体中硫的配位数为___________ ,晶胞底面的边长a=5.75 nm,高h=10.30nm,该晶体密度为__________________ g·cm-3(列出计算式即可)。
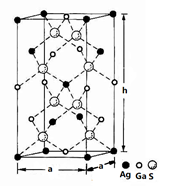
(1)基态Ga原子占据最高能级电子的电子云轮廓图形状为
(2)Ga(NO3)3中阴离子的立体构型是
(3)2-甲基-8-羟基喹啉镓(如图)应用于分子印迹技术,2-甲基-8-羟基喹啉镓中五种元素电负性由大到小的顺序是

(4)一种硅镓半导体材料的晶胞结构如图所示由硫、镓、银形成的化合物的晶胞是底面为正方形的长方体,结构如下图所示,则该晶体中硫的配位数为

您最近一年使用:0次
2018-04-28更新
|
345次组卷
|
2卷引用:【全国市级联考】安徽省淮北市2018届高三第二次模拟考试理综化学试题
12-13高三上·安徽滁州·阶段练习
解题方法
10 . 下列说法中正确的是 ( )
| A.第三周期所包含的元素中钠的原子半径最小 |
| B.钠的第一电离能比镁的第一电离能大 |
| C.在所有元素中,氟的电负性最大 |
| D.电子云示意图中的每个小黑点都表示一个电子 |
您最近一年使用:0次
2016-07-01更新
|
168次组卷
|
5卷引用:2013届安徽省来安县半塔中学高三上学期第一次月考化学试卷
(已下线)2013届安徽省来安县半塔中学高三上学期第一次月考化学试卷2020届高三化学二轮物质结构题型专攻——核外电子排布和运动【选择基础专练】(已下线)2012-2013学年江苏省郑梁梅中学高二下学期期末考试化学试卷2015-2016学年辽宁省五校协作体高二下学期期中考试化学试卷黑龙江省大庆市高中2020-2021学年高二下学期期末考试化学试题



