名校
1 . 下列说法正确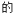 是
是
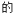 是
是| A.基态原子的2s电子的能量较高,其一定在比1s电子离核更远的区域运动 |
| B.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的d区 |
C.处于最低能量的原子叫做基态原子, → → 过程中形成的是吸收光谱 过程中形成的是吸收光谱 |
| D.最外层电子数为ns2的元素都在元素周期表第2列或第18列 |
您最近一年使用:0次
名校
解题方法
2 . 具有下列电子层结构的原子或离子,其对应元素一定属于同一周期的是
| A.两原子核外全部都是s电子 |
B.最外层电子排布式为 的原子和最外层电子排布式为 的原子和最外层电子排布式为 的离子 的离子 |
C.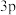 能级上只有一个空轨道的原子和 能级上只有一个空轨道的原子和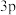 能级上只有一个未成对电子的原子 能级上只有一个未成对电子的原子 |
D.原子核外M层上的s、p能级都充满电子,而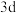 能级上没有电子的原子和离子 能级上没有电子的原子和离子 |
您最近一年使用:0次
2024-01-14更新
|
286次组卷
|
4卷引用:黑龙江省哈尔滨市六校联考2023-2024学年高二上学期1月期末化学试题
3 . 一种可吸附甲醇的材料,其化学式为 ,部分晶体结构如下图所示,其中
,部分晶体结构如下图所示,其中 为平面结构。
为平面结构。
 ,部分晶体结构如下图所示,其中
,部分晶体结构如下图所示,其中 为平面结构。
为平面结构。 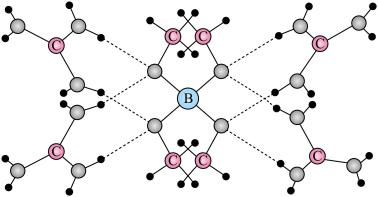
| A.该晶体中存在N-H…O氢键 | B.基态原子的第一电离能: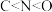 |
C.基态原子未成对电子数: | D.晶体中B、N和O原子轨道的杂化类型相同 |
您最近一年使用:0次
2023-06-10更新
|
14384次组卷
|
22卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高二下学期期末考试化学试题
黑龙江省哈尔滨师范大学附属中学2022-2023学年高二下学期期末考试化学试题新疆生产建设兵团第三师图木舒克市第一中学2022-2023学年高二下学期期末考试化学试题河南省商丘名校联考2022-2023学年高二下学期7月期末考试化学试题2023年高考新课标理综化学真题(已下线)T9-物质结构(已下线)2023年高考化学真题完全解读(新课标卷:适用安徽、云南、山西、吉林、黑龙江五省)(PPT+Word)(已下线)专题06 物质结构与性质(已下线)专题06 物质结构与性质(已下线)专题06 物质结构与性质(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)(已下线)考点41 原子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第4讲 空间构型(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)T9-物质结构与性质江苏省南菁高中、常州市第一中学2023-2024学年高二下学期3月月考化学试题湖北省襄阳市第一中学2023-2024学年高二下学期3月月考化学试题山东省枣庄市第八中学三校区2023-2024学年高二下学期联考化学试卷云南省宣威市第九中学2023-2024学年高三下学期入学考试理综试题-高中化学(已下线)FHgkyldyjhx06广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题2024届河南省郑州市第一中学高三下学期考前全真模拟考试理科综合试题-高中化学
名校
4 . 隐形战机的核心材料是金属钛,我国探明储量世界第一,下列有关推断不正确的是
| A.钛的原子序数为22 | B.钛位于元素周期表第四周期IVB族 |
C.基态钛原子价层电子排布式为 | D.钛属于过渡元素 |
您最近一年使用:0次
名校
解题方法
5 . 不锈钢是由铁、铬、碳及众多不同元素所组成的合金。目前铬被广泛应用于冶金、化工、铸铁、耐火等领域。
(1)Cr基态原子价层电子的轨道表示式(电子排布图)为_______ 。其核外有_______ 种能量状态的电子。
(2)金属铬的第二电离能(ICr)和锰的第二电离能(IMn)分别为1590.6kJ·mol-1、1509.0kJ·mol-1,ICr>IMn的原因是_______ 。
(3)过氧化铬(CrO5)中Cr的化合价为+6,则分子中σ键、π键的数目之比为_______ 。
(4)CrCl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为_______ 。
(5)Cr的一种配合物结构如图所示,该配合物中碳原子的杂化方式是_______ ,阳离子中Cr的配位数为_______ ,阴离子 的空间构型为
的空间构型为_______ 。

(6)氮化铬晶体的晶胞结构如图所示,如果N与Cr核间距离为apm,则氮化铬的密度为_______ g·cm-3(只要求列算式,不必计算数值)

(1)Cr基态原子价层电子的轨道表示式(电子排布图)为
(2)金属铬的第二电离能(ICr)和锰的第二电离能(IMn)分别为1590.6kJ·mol-1、1509.0kJ·mol-1,ICr>IMn的原因是
(3)过氧化铬(CrO5)中Cr的化合价为+6,则分子中σ键、π键的数目之比为
(4)CrCl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为
(5)Cr的一种配合物结构如图所示,该配合物中碳原子的杂化方式是
 的空间构型为
的空间构型为
(6)氮化铬晶体的晶胞结构如图所示,如果N与Cr核间距离为apm,则氮化铬的密度为

您最近一年使用:0次
名校
解题方法
6 . 五种前四周期的元素X、Y、Q、W、T。已知X元素基态原子的M层有6种运动状态不同的电子;Y元素的+3价阳离子的3d能级半充满;Q原子的L电子层的p能级只有一对成对电子;基态W元素与Q同周期,W元素最高能级的不同轨道都有电子,且自旋方向相同;基态T原子的M电子层上p轨道半充满。下列说法不正确的是
| A.X、Q、T三种元素第一电离能的大小次序是:Q>X>T |
| B.X、T、W的最高价的氧化物对应的水化物中有两个是强酸 |
| C.Y元素在周期表d区的VIII族 |
| D.元素Q与另四种元素形成的二元化合物均不止一种 |
您最近一年使用:0次
2022-07-14更新
|
149次组卷
|
3卷引用:黑龙江省七台河市第一中学2021-2022学年高二下学期期末考试化学试题
解题方法
7 . 用图示的方法能够直观形象地将化学知识传授给学生,下列图示正确的是
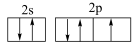 |  | 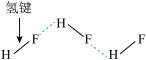 | 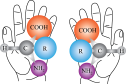 |
| A.违背了泡利原理 | B.BF 的结构式 的结构式 | C.HF分子间的氢键 | D.互为“镜像”关系的手性异构体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . 下列电子排布式中不正确的是
| A.29Cu:1s22s22p63s23p63d104s1 | B.26Fe:1s22s22p63s23p63d64s2 |
| C.23V:1s22s22p63s23p63d34s2 | D.24Cr:1s22s22p63s23p63d44s2 |
您最近一年使用:0次
2022-04-24更新
|
136次组卷
|
2卷引用:黑龙江省富锦市第一中学2022-2023学年高二上学期期末考试化学试题
9 . 下列说法正确的是
| A.态Fe3+的最外层电子排布式为: 3s23p63d5 |
B.基态碳原子价电子轨道表示式: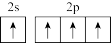 |
C.轨道表示式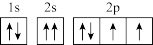 违背了洪特规则 违背了洪特规则 |
D.价层电子轨道表示式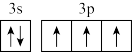 违背了泡利原理 违背了泡利原理 |
您最近一年使用:0次
2022-03-17更新
|
736次组卷
|
4卷引用:黑龙江省哈尔滨市宾县第二中学2021-2022学年高二下学期期末考试化学试题
名校
10 . 通常情况下,原子核外p、d能级等原子轨道上电子排布为“全空”“半充满”“全充满”的时候更加稳定,称为洪特规则的特例,下列事实能作为这个规则的证据的是
①基态He原子的电子排布式为1s2,基态H原子的电子排布式为1s1
②Fe2+容易失电子转变为Fe3+,表现出较强的还原性
③基态Cu原子的电子排布式是[Ar]3d104s1而不是[Ar]3d94s2
④某种激发态碳原子的电子排布式是1s22s12p3而不是1s22s22p2
①基态He原子的电子排布式为1s2,基态H原子的电子排布式为1s1
②Fe2+容易失电子转变为Fe3+,表现出较强的还原性
③基态Cu原子的电子排布式是[Ar]3d104s1而不是[Ar]3d94s2
④某种激发态碳原子的电子排布式是1s22s12p3而不是1s22s22p2
| A.①② | B.②③ | C.③④ | D.①②③④ |
您最近一年使用:0次
2022-03-15更新
|
666次组卷
|
5卷引用:黑龙江省实验中学2023-2024学年高二上学期1月期末化学试题



