1 . 某元素基态原子的外围电子排布为3d54s2,则下列说法正确的是
| A.该元素为Mn元素 |
| B.该元素属于ds区元素 |
| C.该元素最高化合价为+2 |
| D.该元素原子最外层共有7个电子 |
您最近一年使用:0次
2023-04-07更新
|
246次组卷
|
4卷引用:甘肃省临洮县第二中学2022-2023学年高二下学期第一次月考化学试题
2 . 现有四种元素基态原子的电子排布式如下。则下列有关比较中正确的是
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
| A.第一电离能:④>③>①>② | B.原子半径:②>①>③>④ |
| C.电负性:④>①>②>③ | D.最高正化合价:④>③=②>① |
您最近一年使用:0次
2023-04-07更新
|
590次组卷
|
6卷引用:甘肃省张掖市高台县第一中学2022-2023学年高二下学期4月月考化学试题
名校
解题方法
3 . 下列说法正确的是
| A.最外层电子排布式为ns2的基态原子所对应元素一定位于ⅡA 族 |
| B.d区元素的原子定都有d轨道电子 |
| C.最外层电子排布式为ns1的基态原子所对应元素一定是金属元素 |
| D.基态原子价电子排布式为nsnnpn的元素一定是金属元素 |
您最近一年使用:0次
2023-04-06更新
|
356次组卷
|
13卷引用:甘肃省静宁县第一中学2020-2021学年高二上学期第二次月考(实验班)化学试题
甘肃省静宁县第一中学2020-2021学年高二上学期第二次月考(实验班)化学试题(已下线)专题一 原子结构-2020-2021学年高二《新题速递·化学》(人教版选修3)2月刊 (同步课堂必刷题)(已下线)1.1 原子结构(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)(已下线)专题一 原子结构-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修2)2月刊 (同步课堂必刷题)(已下线)第1章 原子结构与元素性质(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)安徽省白泽湖中学2020-2021学年高二下学期期中考试化学试题(已下线)第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)抚顺市第一中学2021-2022学年高二下学期开学考试化学试题四川省绵阳市盐亭中学2022-2023学年高二上学期第一次月考教学质量检测化学试题辽宁省沈阳市同泽中学2022-2023学年高二12月月考化学试题(已下线)高二上期末考化学192(已下线)第1讲 原子结构 核外电子排布吉林省通化市梅河口市第五中学2023-2024学年高二上学期第三次月考化学试题
名校
解题方法
4 . 2023年1月30日,中国科学院朱庆山团队研究六方相砷化镍(NiAs)型到正交相磷化锰(MnP)型结构转变,实现了对锂硫催化剂的精确设计。回答下列问题:
(1)Li、P、S三种元素中,电负性最小的是___________ 。第三周期元素中第一电离能比P大的元素有___________ 种。
(2)基态S原子核外有___________ 个电子自旋状态相同。基态As原子的电子排布式为___________ 。
(3)PH3、AsH3中沸点较高的是___________ ,其主要原因是___________ 。
(4)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],该配合物中锰原子的配位数为___________ 。
(5)CH3CN中C原子的杂化类型为___________ 。
(6)等物质的量的CH3CN和CO中,π键数目之比___________ 。
(7)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρ g/cm3,则该晶胞中最近的砷原子之间的距离为___________ pm。

(1)Li、P、S三种元素中,电负性最小的是
(2)基态S原子核外有
(3)PH3、AsH3中沸点较高的是
(4)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],该配合物中锰原子的配位数为
(5)CH3CN中C原子的杂化类型为
(6)等物质的量的CH3CN和CO中,π键数目之比
(7)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρ g/cm3,则该晶胞中最近的砷原子之间的距离为

您最近一年使用:0次
2023-04-06更新
|
735次组卷
|
4卷引用:甘肃省武威第一中学2023-2024学年高三上学期第三次月考化学试题
甘肃省武威第一中学2023-2024学年高三上学期第三次月考化学试题河南省郑州市2023届高三下学期第二次质量预测理科综合化学试题(已下线)化学-2023年高考押题预测卷03(山东卷)(含考试版、全解全析、参考答案、答题卡)(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
5 .  具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用一直是科学研究的重要课题。
的合成及应用一直是科学研究的重要课题。
(1)以 、
、 合成
合成 ,Fe是常用的催化剂。
,Fe是常用的催化剂。 遇酸能转化成铵盐。
遇酸能转化成铵盐。
① 中N原子的杂化类型为
中N原子的杂化类型为_______ ;VSEPR模型为_______ 。
②实际生产中采用铁的氧化物 、FeO,使用前用
、FeO,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:

图1晶胞的棱长为a pm(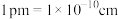 ),
), 代表阿伏加德罗常数,则其密度
代表阿伏加德罗常数,则其密度
_______  。
。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为_______ 。
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、
、 、CaO、MgO、
、CaO、MgO、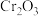 等氧化物中的几种。
等氧化物中的几种。
①第四周期ds区元素中,与基态Cr原子最外层电子数目相同的元素的元素符号为_______ 。
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有_______ (填元素符号)
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1 MPa,这是近年来合成氨反应研究中的重要突破。
①基态Mn原子未成对的电子数为_______ 。
②第三电离能
_______  (填“>”或“<”),原因是
(填“>”或“<”),原因是_______ 。
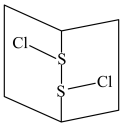
(5)常温下 是橙黄色液体,其分子结构如图所示。少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液。
是橙黄色液体,其分子结构如图所示。少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液。 分子是
分子是_______ 分子(填“极性”或“非极性”),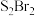 与
与 分子结构相似,熔沸点
分子结构相似,熔沸点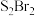
_______  (填“>”或“<”)。
(填“>”或“<”)。
 具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用一直是科学研究的重要课题。
的合成及应用一直是科学研究的重要课题。(1)以
 、
、 合成
合成 ,Fe是常用的催化剂。
,Fe是常用的催化剂。 遇酸能转化成铵盐。
遇酸能转化成铵盐。①
 中N原子的杂化类型为
中N原子的杂化类型为②实际生产中采用铁的氧化物
 、FeO,使用前用
、FeO,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
图1晶胞的棱长为a pm(
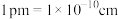 ),
), 代表阿伏加德罗常数,则其密度
代表阿伏加德罗常数,则其密度
 。
。(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
 、
、 、CaO、MgO、
、CaO、MgO、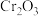 等氧化物中的几种。
等氧化物中的几种。①第四周期ds区元素中,与基态Cr原子最外层电子数目相同的元素的元素符号为
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1 MPa,这是近年来合成氨反应研究中的重要突破。
①基态Mn原子未成对的电子数为
②第三电离能

 (填“>”或“<”),原因是
(填“>”或“<”),原因是(5)常温下
 是橙黄色液体,其分子结构如图所示。少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液。
是橙黄色液体,其分子结构如图所示。少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液。 分子是
分子是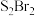 与
与 分子结构相似,熔沸点
分子结构相似,熔沸点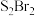
 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
2023-03-31更新
|
96次组卷
|
2卷引用:甘肃省张掖市 高台县第一中学2022-2023学年高二下学期3月月考化学试题
6 . 已知A、B、C三种元素的原子中,质子数:A<B<C,且都小于18,A元素原子的最外层电子数是次外层电子数的4倍;B元素的原子核外M层电子数是L层电子数的一半;C元素原子的次外层电子数比最外层电子数多3。试回答下列问题:
(1)写出三种元素的名称和符号:A___________ ,B___________ ,C___________ 。
(2)写出三种元素的原子核外电子排布式A___________ ,B___________ ,C___________ 。
(1)写出三种元素的名称和符号:A
(2)写出三种元素的原子核外电子排布式A
您最近一年使用:0次
7 . 丁二酮肟(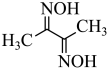 )可与
)可与 反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定
反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定 的存在。请回答下列问题:
的存在。请回答下列问题:
(1)Ni在元素周期表中的位置为___________ 。
(2)基态氧原子的核外电子的空间运动状态有___________ 种。
(3)丁二酮肟( )中涉及元素的电负性由大到小的顺序为
)中涉及元素的电负性由大到小的顺序为___________ ;与氮同周期的硼在成键时,能将一个2s电子激发进入2p能级参与形成化学键,请写出该激发态原子的价电子轨道表示式:___________ ,该过程形成的原子光谱为___________ (填“吸收”或“发射”)光谱。
(4)与Ni同周期的铜、锌两种元素位于元素周期表的___________ 区,两元素的第一电离能( )、第二电离能(
)、第二电离能( )数据如表所示:
)数据如表所示:
铜的 小于锌,
小于锌, 却大于锌的主要原因是
却大于锌的主要原因是___________ 。
 )可与
)可与 反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定
反应,生成鲜红色的沉淀丁二酮肟镍,这个反应可用来鉴定 的存在。请回答下列问题:
的存在。请回答下列问题:(1)Ni在元素周期表中的位置为
(2)基态氧原子的核外电子的空间运动状态有
(3)丁二酮肟(
 )中涉及元素的电负性由大到小的顺序为
)中涉及元素的电负性由大到小的顺序为(4)与Ni同周期的铜、锌两种元素位于元素周期表的
 )、第二电离能(
)、第二电离能( )数据如表所示:
)数据如表所示:电离能/( ) ) |  |  |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
 小于锌,
小于锌, 却大于锌的主要原因是
却大于锌的主要原因是
您最近一年使用:0次
2023-03-30更新
|
469次组卷
|
7卷引用:甘肃省张掖市高台县第一中学2022-2023学年高二下学期4月月考化学试题
名校
8 . 含主族元素N、F、Cl、As、Se等的某些化合物对工农业生产意义重大,下列说法正确的是
| A.N元素基态原子所有价电子的电子云轮廓图均为哑铃形 |
| B.Se元素基态原子的电子排布式为[Ar]4s24p4 |
| C.O、F、Cl电负性由大到小的顺序为F>Cl>O |
| D.第一电离能As>Se |
您最近一年使用:0次
2023-03-24更新
|
540次组卷
|
4卷引用:甘肃省张掖市高台县第一中学2022-2023学年高二下学期4月月考化学试题
名校
9 . DF-31洲际弹道导弹是我国大国地位和国防实力的象征,其制作材料包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的电子排布式为_______ , 具有较强的还原性,原因是
具有较强的还原性,原因是_______ 。
(2)基态Ni原子的核外能量不同的电子有_______ 种。
(3)Cr的第二电离能 和Mn的第二电离能
和Mn的第二电离能 分别为1590.6 kJ·mol
分别为1590.6 kJ·mol 、1509.0 kJ·mol
、1509.0 kJ·mol ,
, 的原因是
的原因是_______ ;过氧化铬 中Cr的化合价为+6,则分子中σ键、π键的数目之比为
中Cr的化合价为+6,则分子中σ键、π键的数目之比为_______ 。
(4)指出下列过程需要破坏的作用力:干冰熔化_______ ;氢氧化钠溶于水_______ ;氯化氢溶于水_______ ;冰的熔化_______ 。
①离子键②极性共价键③非极性共价键④氢键⑤范德华力
(1)基态铁原子的电子排布式为
 具有较强的还原性,原因是
具有较强的还原性,原因是(2)基态Ni原子的核外能量不同的电子有
(3)Cr的第二电离能
 和Mn的第二电离能
和Mn的第二电离能 分别为1590.6 kJ·mol
分别为1590.6 kJ·mol 、1509.0 kJ·mol
、1509.0 kJ·mol ,
, 的原因是
的原因是 中Cr的化合价为+6,则分子中σ键、π键的数目之比为
中Cr的化合价为+6,则分子中σ键、π键的数目之比为(4)指出下列过程需要破坏的作用力:干冰熔化
①离子键②极性共价键③非极性共价键④氢键⑤范德华力
您最近一年使用:0次
2023-03-16更新
|
266次组卷
|
2卷引用:甘肃省临洮县第二中学2022-2023学年高二下学期第一次月考化学试题
名校
解题方法
10 . 下列选项中的两种元素易形成离子键的是
A.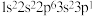 和 和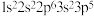 | B. 和 和 |
C. 和 和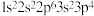 | D.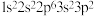 和 和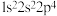 |
您最近一年使用:0次
2023-03-16更新
|
219次组卷
|
4卷引用:甘肃省临洮县第二中学2022-2023学年高二下学期第一次月考化学试题



