名校
解题方法
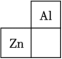
1 . 锌在工业中有重要作用,也是人体必需的微量元素。锌元素在周期表中的位置如图所示。___________ ,其核外电子共占据 ___________ 条轨道。
(2)自然界中共存在五种常见的锌的稳定同位素,其中丰度最高的核素含有34个中子,该核素可以表示为 ___________。
(3)中医典籍中记载了炉甘石(ZnCO3)可用于治疗皮肤炎症或表面创伤。ZnCO3中,负离子的空间构型为 ___________ ,Zn、C、O的电负性由小到大的顺序是 ___________ 。
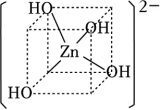
(4)锌的氢氧化物既能溶于强酸,又能溶于强碱。Zn(OH)2溶于强碱生成[Zn(OH)4]2﹣,结构如图所示。该微粒中OH﹣提供孤电子对,Zn2+提供___________ ,Zn2+的杂化方式为 ___________ 。
解释ZnCl2与ZnBr2熔点存在差异的原因 ___________ 。
(6)ZnF2晶胞如图所示,一个晶胞中含有___________ 个F﹣。若NA表示阿伏加德罗常数的值,则ZnF2晶体(摩尔质量为M)的密度为 ___________ g•cm-3(用含a、c、M、NA的代数式表示)。
(2)自然界中共存在五种常见的锌的稳定同位素,其中丰度最高的核素含有34个中子,该核素可以表示为 ___________。
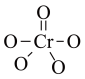
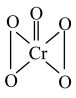
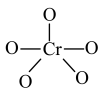
| A.34Zn | B.34Zn | C.64Zn | D.64Zn |
(4)锌的氢氧化物既能溶于强酸,又能溶于强碱。Zn(OH)2溶于强碱生成[Zn(OH)4]2﹣,结构如图所示。该微粒中OH﹣提供孤电子对,Zn2+提供
| 卤化锌 | ZnCl2 | ZnBr2 |
| 熔点/℃ | 283 | 394 |
(6)ZnF2晶胞如图所示,一个晶胞中含有

您最近一年使用:0次
名校
解题方法
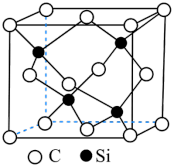
2 . 碳、硅元素及其化合物在生产生活中应用广泛。请回答:
(1)基态硅原子核外电子排布式:_______ 。该基态原子占据最高能级的电子云轮廓图形状为_______ 。
(2)C60晶体采用面心立方堆积,C60晶体中存在的作用力有_______ (填字母)
A.共价键 B.离子键 C.氢键 D.范德华力 E.配位键 F.金属键
(3)与碳的氢化物类似,硅元素的氢化物硅烷的通式为:SinH2n+2。下列有关说法不正确的是_______。
(4)硅酸盐是地壳中的主要成分。硅酸盐的最简单阴离子为SiO ,为硅氧四面体,结构如图1。SiO
,为硅氧四面体,结构如图1。SiO 在溶液中形成的分子形态脱水易形成凝胶状的固体物质—硅胶。硅胶继续脱水,形成了共用氧原子的硅氧四面体骨架—SiO2(硅石)。联系相关信息,解释硅胶转变为硅石后,硬度变大的原因:
在溶液中形成的分子形态脱水易形成凝胶状的固体物质—硅胶。硅胶继续脱水,形成了共用氧原子的硅氧四面体骨架—SiO2(硅石)。联系相关信息,解释硅胶转变为硅石后,硬度变大的原因:_______ 。 ,KCx晶胞结构如图2(碳原子省略),如图3是晶胞沿y轴方向的投影。
,KCx晶胞结构如图2(碳原子省略),如图3是晶胞沿y轴方向的投影。_______ 。
②若石墨层内的大π键可表示为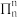 (上标表示电子总数,下标表示原子数),则平均每个KCx单元中的大π键可表示为
(上标表示电子总数,下标表示原子数),则平均每个KCx单元中的大π键可表示为_______ (用具体的数据表示)。
(6)已知 晶体的密度为ρg· cm-3,其晶胞结构如图所示。阿伏加德罗常数值为NA,则晶胞中两个
晶体的密度为ρg· cm-3,其晶胞结构如图所示。阿伏加德罗常数值为NA,则晶胞中两个 原子之间的距离为
原子之间的距离为_______  。
。
(1)基态硅原子核外电子排布式:
(2)C60晶体采用面心立方堆积,C60晶体中存在的作用力有
A.共价键 B.离子键 C.氢键 D.范德华力 E.配位键 F.金属键
(3)与碳的氢化物类似,硅元素的氢化物硅烷的通式为:SinH2n+2。下列有关说法不正确的是_______。
| A.Si3H8没有同分异构体 |
| B.Si-Si键能比C-C键能小,故热稳定性:SinH2n+2>CnH2n+2 |
| C.SinH2n+2中Si原子杂化方式均为sp3 |
| D.SinH2n+2可与水反应生成氢气 |
 ,为硅氧四面体,结构如图1。SiO
,为硅氧四面体,结构如图1。SiO 在溶液中形成的分子形态脱水易形成凝胶状的固体物质—硅胶。硅胶继续脱水,形成了共用氧原子的硅氧四面体骨架—SiO2(硅石)。联系相关信息,解释硅胶转变为硅石后,硬度变大的原因:
在溶液中形成的分子形态脱水易形成凝胶状的固体物质—硅胶。硅胶继续脱水,形成了共用氧原子的硅氧四面体骨架—SiO2(硅石)。联系相关信息,解释硅胶转变为硅石后,硬度变大的原因: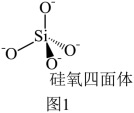
 ,KCx晶胞结构如图2(碳原子省略),如图3是晶胞沿y轴方向的投影。
,KCx晶胞结构如图2(碳原子省略),如图3是晶胞沿y轴方向的投影。
②若石墨层内的大π键可表示为
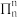 (上标表示电子总数,下标表示原子数),则平均每个KCx单元中的大π键可表示为
(上标表示电子总数,下标表示原子数),则平均每个KCx单元中的大π键可表示为(6)已知
 晶体的密度为ρg· cm-3,其晶胞结构如图所示。阿伏加德罗常数值为NA,则晶胞中两个
晶体的密度为ρg· cm-3,其晶胞结构如图所示。阿伏加德罗常数值为NA,则晶胞中两个 原子之间的距离为
原子之间的距离为 。
。
您最近一年使用:0次
名校
解题方法
3 . 钛硅分子筛是一种新型固体催化剂,可催化合成重要有机合成活性试剂甲乙酮肟(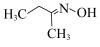 )。回答下列问题:
)。回答下列问题:
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为
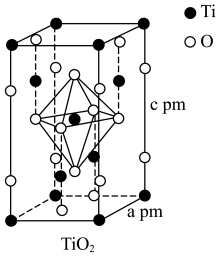
(3)TiO2和TiCl4均是制备钛硅分子筛的重要中间体。
①TiO2与光气COCl2反应可用于制取四氯化钛。COCl2中σ键和π键的数目比为
②TiCl4与金属Ti在高温条件下可反应生成TiCl3,TiCl3中Ti3+极易被氧化,还原性很强。试解释Ti3+还原性强的原因
(4)TiO2晶胞如图所示,若其晶体密度为ρg·cm-3,则阿伏加德罗常数的值NA=
您最近一年使用:0次
4 . 科技创新是引领发展的第一动力。下列说法错误的是
| A.“问天”实验舱采用了砷化镓太阳能电池,砷化镓所含的元素都位于p区 |
| B.中国“人造太阳”创亿度百秒世界新纪录,其中核聚变属于化学变化 |
| C.我国发现了月球新矿物——“嫦娥石”,可以采用X—射线衍射法分析其晶体结构 |
| D.C919飞机采用了碳纤维和玻璃纤维,二者均属于无机非金属材料 |
您最近一年使用:0次
2024-03-26更新
|
392次组卷
|
3卷引用:2024届宁夏石嘴山市第三中学高三下学期四模理综试题-高中化学
名校
解题方法
5 . 铜及其化合物在工农业生产中有广泛的应用。
(1)Cu2+的价电子排布式为_____ 。
(2)Cu2+可以与乙二胺(H2N-CH2CH2-NH2)形成配离子,如图所示:_____ 。
②该配离子中的配体数与配位数之比为_____ 。
③以下三种分子:a.NH3、b.BCl3、c.H2O。键角按由大到小的顺序排列:_____ (用序号表示)。
(3)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有_____
(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是_____(填字母)。
(5)现有四种晶体的晶胞如图所示。下列叙述正确的是_____。
(6)在铜晶胞中,原子的空间利用率为_____ (用含有π的代数式表示)。
(1)Cu2+的价电子排布式为
(2)Cu2+可以与乙二胺(H2N-CH2CH2-NH2)形成配离子,如图所示:
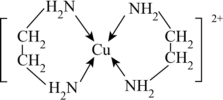
②该配离子中的配体数与配位数之比为
③以下三种分子:a.NH3、b.BCl3、c.H2O。键角按由大到小的顺序排列:
(3)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有
(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是_____(填字母)。
| A.[Cu(NH3)2]Cl | B.[Cu(NH3)4]SO4 |
| C.K3[Fe(CN)6] | D.[Zn(NH₃)4]Cl2 |
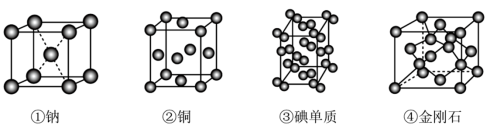
| A.上述晶体涉及4种晶体类型 |
| B.碘升华时破坏了非极性键 |
| C.上述四种晶体中熔点最高的是金刚石 |
| D.1个晶胞中含8个原子的有③④ |
您最近一年使用:0次
2024-03-17更新
|
214次组卷
|
2卷引用:宁夏石嘴山市第三中学2024届高三第一次模拟考试理综-化学试题
6 . 完成下列问题。
(1)Ni2+和Fe2+可形成如图所示的配合物离子,其中Ni2+的外围电子排布式为___________ ,S元素的杂化方式为 ___________ 。该配合物离子中,C≡O(Ⅰ)和气态C≡O分子(Ⅱ),键长较长的为 ___________ (用Ⅰ或Ⅱ表示)。
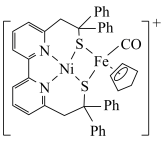
(2)写出SCN﹣的一个等电子体分子___________ ,检验Fe3+时,SCN﹣以S原子配位不以N原子配位的原因是 ___________ 。
(3)氮化镓(GaN)和砷化镓(GaAs)都是新型的半导体材料,GaN的熔点________ GaAs熔点,原因是 ___________ 。
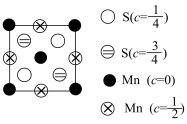
(4)阿拉班达石(alabandite)是一种属于立方晶系的硫锰矿,其晶胞如图(●=Mn,〇=S),锰原子堆积方式为___________ 堆积。
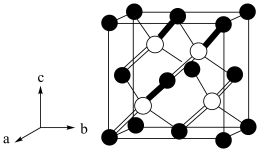
已知阿拉班达石晶胞中最近两个硫原子之间的距离为dÅ(1Å=10﹣10m),晶体密度为ρg•cm﹣3,则阿伏加德罗常数的值NA=_________ (要求化简)。
(5)为更清晰地展示晶胞中原子所在的位置,晶体化学中常将立体晶胞结构转化为平面投影图。例如沿阿拉班达石晶胞的c轴将原子投影到ab平面,即可用如图表示,下列晶体结构投影可能表示MnS晶体的是_________。
(1)Ni2+和Fe2+可形成如图所示的配合物离子,其中Ni2+的外围电子排布式为

(2)写出SCN﹣的一个等电子体分子
(3)氮化镓(GaN)和砷化镓(GaAs)都是新型的半导体材料,GaN的熔点
(4)阿拉班达石(alabandite)是一种属于立方晶系的硫锰矿,其晶胞如图(●=Mn,〇=S),锰原子堆积方式为

已知阿拉班达石晶胞中最近两个硫原子之间的距离为dÅ(1Å=10﹣10m),晶体密度为ρg•cm﹣3,则阿伏加德罗常数的值NA=
(5)为更清晰地展示晶胞中原子所在的位置,晶体化学中常将立体晶胞结构转化为平面投影图。例如沿阿拉班达石晶胞的c轴将原子投影到ab平面,即可用如图表示,下列晶体结构投影可能表示MnS晶体的是_________。

A.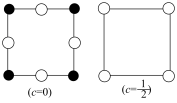 | B.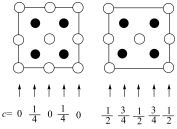 |
C.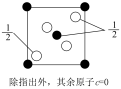 | D.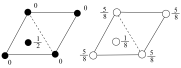 |
您最近一年使用:0次
名校
解题方法
7 . 铁及其化合物在生产、生活中有重要应用。回答下列问题:
(1)基态Fe3+的价电子排布式为___________ 。
(2)某铁的配合物结构如图1所示,可由(CH3)3SiCl与K[Fe(C5H5)(CO)2CO2]混合加热制得。___________ 。
②C5H 表示环戊二烯负离子,已知分子中的大π键可用符号π
表示环戊二烯负离子,已知分子中的大π键可用符号π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ),则C5H
),则C5H 中的大π键应表示为
中的大π键应表示为___________ 。
③该铁的配合物中碳原子的杂化方式共有___________ 种。
(3)普鲁士蓝晶体属立方晶系,晶胞棱长为apm。铁-氰骨架组成小立方体,Fe粒子在顶点,CN-在小正方体的棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图2所示(CN-在图中省略)。___________ ;该晶胞的化学式为___________ 。
②若所有铁粒子为等径小球,则K+与Fe2+之间最近距离为___________ pm;该晶体的密度为___________ g•cm-3(阿伏加德罗常数为NA)。
(1)基态Fe3+的价电子排布式为
(2)某铁的配合物结构如图1所示,可由(CH3)3SiCl与K[Fe(C5H5)(CO)2CO2]混合加热制得。

②C5H
 表示环戊二烯负离子,已知分子中的大π键可用符号π
表示环戊二烯负离子,已知分子中的大π键可用符号π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ),则C5H
),则C5H 中的大π键应表示为
中的大π键应表示为③该铁的配合物中碳原子的杂化方式共有
(3)普鲁士蓝晶体属立方晶系,晶胞棱长为apm。铁-氰骨架组成小立方体,Fe粒子在顶点,CN-在小正方体的棱上,两端均与Fe相连,立方体中心空隙可容纳K+,如图2所示(CN-在图中省略)。

②若所有铁粒子为等径小球,则K+与Fe2+之间最近距离为
您最近一年使用:0次
2023-06-19更新
|
154次组卷
|
4卷引用:2023届宁夏石嘴山第三中学高三下学期第四次模拟理科综合试题
2023届宁夏石嘴山第三中学高三下学期第四次模拟理科综合试题宁夏回族自治区石嘴山市第三中学2022-2023学年高三下学期第四次模拟考试理综化学试题(已下线)物质结构与性质(已下线)T35-物质结构与性质
8 . Fe、Co、Ni是重要的过渡金属元素。回答下列问题:
(1)①Co在周期表中的位置为_____ 。
②量子力学用四个量子数描述原子核外电子运动状态,其中用自旋量子数描述电子的自旋状态,并规定两种自旋状态电子的自旋量子数分别为+ 、-
、- ,则基态镍原子的价电子自旋量子数代数和为
,则基态镍原子的价电子自旋量子数代数和为_____ 中,基态Co原子的核外电子排布式为_____ 。
(2)镍能形成多种配合物,如正四面体形的Ni(CO)4和正方形的[Ni(CN)4]2-、正八面体形的Ni(NH3)6]2+等。
①CO与CN-原子总数价电子总数相同,具有相似的结构特征,其中CO分子内σ键和π键个数之比为_____ 。
②NH3的空间结构为_____ 。
③配离[Ni(CN)4]2-和[Ni(NH3)6]2+中,Ni2+的配位数分别为_____ 。
(3)镍能形成多种氧化物,一种镍的氧化物的晶胞结构特征为:氧离子形成面心立方结构,镍离子位于氧离子构成的八面体空隙中。下图中的_____ (填标号)是从该晶胞中分割出来的结构。
a. b.
b.  c.
c.  d.
d. e.
e. 
已知该晶体密度为ρg·cm-3,NA为阿伏加德罗常数的值,则晶胞中两个镍离子之间的最短距离为_____ pm(用含p和NA的代数式表示)。
(1)①Co在周期表中的位置为
②量子力学用四个量子数描述原子核外电子运动状态,其中用自旋量子数描述电子的自旋状态,并规定两种自旋状态电子的自旋量子数分别为+
 、-
、- ,则基态镍原子的价电子自旋量子数代数和为
,则基态镍原子的价电子自旋量子数代数和为(2)镍能形成多种配合物,如正四面体形的Ni(CO)4和正方形的[Ni(CN)4]2-、正八面体形的Ni(NH3)6]2+等。
①CO与CN-原子总数价电子总数相同,具有相似的结构特征,其中CO分子内σ键和π键个数之比为
②NH3的空间结构为
③配离[Ni(CN)4]2-和[Ni(NH3)6]2+中,Ni2+的配位数分别为
(3)镍能形成多种氧化物,一种镍的氧化物的晶胞结构特征为:氧离子形成面心立方结构,镍离子位于氧离子构成的八面体空隙中。下图中的
a.
 b.
b.  c.
c.  d.
d. e.
e. 
已知该晶体密度为ρg·cm-3,NA为阿伏加德罗常数的值,则晶胞中两个镍离子之间的最短距离为
您最近一年使用:0次
名校
解题方法
9 . 我国科学家研究发现 (
(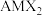 家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
(1)基态铬原子的电子排布式为_________ ;基态硫原子核外电子中含有_________ 个未成对电子。
(2)同周期元素Si、P、S的电负性由大到小的顺序为________________ (用元素符号表示),O、S为同主族元素, 的键角比
的键角比 大的原因是
大的原因是________________ 。
(3)硫元素能形成多种微粒如 、
、 、
、 、
、 、
、 等,
等, 的中心原子的杂化类型为
的中心原子的杂化类型为_______________ , 的空间构型为
的空间构型为________ 。
(4)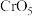 中
中 元素化合价为+6价,常温下呈蓝色,则其结构式可能为
元素化合价为+6价,常温下呈蓝色,则其结构式可能为________ (填标号)。
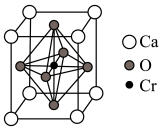
(5)某含铬化合物立方晶胞如图所示。该晶体的化学式为_____________ ;与Cr最近的氧原子的个数为________ ; 和
和 的最近距离为a nm,设
的最近距离为a nm,设 为阿伏加德罗常数的值,则该晶体密度
为阿伏加德罗常数的值,则该晶体密度______________  (填含a、
(填含a、 的表达式)。
的表达式)。
 (
(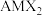 家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:(1)基态铬原子的电子排布式为
(2)同周期元素Si、P、S的电负性由大到小的顺序为
 的键角比
的键角比 大的原因是
大的原因是(3)硫元素能形成多种微粒如
 、
、 、
、 、
、 、
、 等,
等, 的中心原子的杂化类型为
的中心原子的杂化类型为 的空间构型为
的空间构型为(4)
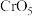 中
中 元素化合价为+6价,常温下呈蓝色,则其结构式可能为
元素化合价为+6价,常温下呈蓝色,则其结构式可能为
|
|
|
A | B | C |
 和
和 的最近距离为a nm,设
的最近距离为a nm,设 为阿伏加德罗常数的值,则该晶体密度
为阿伏加德罗常数的值,则该晶体密度 (填含a、
(填含a、 的表达式)。
的表达式)。
您最近一年使用:0次
10 . H、N、O、S、Fe、Cu是日常生活中常见的元素。
(1)基态Fe2+的核外电子排布式为_______ ,Fe3+有_______ 种能量不同的电子。
(2)[Cu (NH3)4]SO4·H2O中,Cu2+的配位数为_______ , 的空间构型是
的空间构型是_______ 。
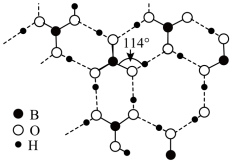
(3)硼酸晶体是片层结构如图所示,其中键角∠B-O-H(114° ),则硼酸晶体中氧原子的杂化方式是_______ 。键角∠B-O-H不同于键角 ∠O-B-O的原因是_______ 。
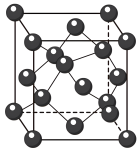
(4)GaN (相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿Z轴从上往下俯视的晶胞投影图如下图所示。
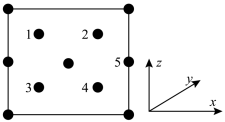
①若图中原子1的分数坐标是( ,
, ,
, )则原子5的分数坐标是
)则原子5的分数坐标是_______ 。
②晶胞结构中原子1、5之间的距离为_______ cm。
③设阿伏加德罗常数的值为NA,则GaN晶体的密度为_______ g·cm-3。
(1)基态Fe2+的核外电子排布式为
(2)[Cu (NH3)4]SO4·H2O中,Cu2+的配位数为
 的空间构型是
的空间构型是(3)硼酸晶体是片层结构如图所示,其中键角∠B-O-H(114° ),则硼酸晶体中氧原子的杂化方式是

(4)GaN (相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿Z轴从上往下俯视的晶胞投影图如下图所示。


①若图中原子1的分数坐标是(
 ,
, ,
, )则原子5的分数坐标是
)则原子5的分数坐标是②晶胞结构中原子1、5之间的距离为
③设阿伏加德罗常数的值为NA,则GaN晶体的密度为
您最近一年使用:0次