名校
解题方法
1 . 铝和氟的化合物在制造、化工等领域都有广泛应用。回答下列问题:
(1)基态铝原子的核外电子排布式为_______ ,基态铝原子比基态镁原子的第一电离能小,其原因是_______ 。
(2)通常情况下, 可由六氟铝酸铵
可由六氟铝酸铵 受热分解制得,同时还生成
受热分解制得,同时还生成 和氨气,请写出该反应的化学方程式:
和氨气,请写出该反应的化学方程式:_______ 。(方程式一定要标明反应条件“ ”和生成物状态“↑”)
”和生成物状态“↑”)
(3) 具有较高的熔点
具有较高的熔点 ,属于
,属于_______ (填“分子”或“离子”)晶体。
(4) 在水溶液中实际上是以
在水溶液中实际上是以 的形式存在。其中
的形式存在。其中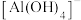 为配离子,
为配离子, 原子的杂化方式为
原子的杂化方式为_______ (填“ 或者
或者 ”))杂化,该阴离子中存在的化学键有
”))杂化,该阴离子中存在的化学键有_______ (填字母)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)萤石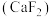 晶体的晶胞如图所示,已知立方体边长为
晶体的晶胞如图所示,已知立方体边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为_______  (列出计算式)。
(列出计算式)。
(1)基态铝原子的核外电子排布式为
(2)通常情况下,
 可由六氟铝酸铵
可由六氟铝酸铵 受热分解制得,同时还生成
受热分解制得,同时还生成 和氨气,请写出该反应的化学方程式:
和氨气,请写出该反应的化学方程式: ”和生成物状态“↑”)
”和生成物状态“↑”)(3)
 具有较高的熔点
具有较高的熔点 ,属于
,属于(4)
 在水溶液中实际上是以
在水溶液中实际上是以 的形式存在。其中
的形式存在。其中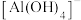 为配离子,
为配离子, 原子的杂化方式为
原子的杂化方式为 或者
或者 ”))杂化,该阴离子中存在的化学键有
”))杂化,该阴离子中存在的化学键有A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)萤石
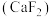 晶体的晶胞如图所示,已知立方体边长为
晶体的晶胞如图所示,已知立方体边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为 (列出计算式)。
(列出计算式)。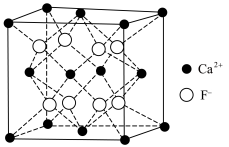
您最近一年使用:0次
名校
解题方法
2 . 某种离子液体的阴离子结构如图,Q、W、X、Y、Z五种短周期元素的原子半径依次增大,基态Q原子的电子填充3个能级,有4对成对电子,Z与其他元素不在同一周期,下列说法正确的是
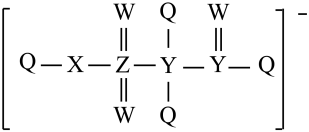
| A.最高价氧化物对应水化物的酸性:Q>X |
| B.Q、W、X的第一电离能依次减小 |
| C.氢化物的沸点:W>Y |
| D.X、Y、Z均至少有两种氧化物 |
您最近一年使用:0次
2024-05-05更新
|
171次组卷
|
2卷引用:湖南省衡阳市衡阳县第一中学2023-2024学年高二下学期4月期中考试化学试题
名校
3 . 一种可吸附甲醇的材料,其化学式为 ,部分晶体结构如图所示,其中
,部分晶体结构如图所示,其中 为平面结构。
为平面结构。
 ,部分晶体结构如图所示,其中
,部分晶体结构如图所示,其中 为平面结构。
为平面结构。
A.该晶体中存在 氢键 氢键 |
B. 中C原子为 中C原子为 杂化 杂化 |
C.基态原子的未成对电子数: |
D.基态原子的第一电离能: |
您最近一年使用:0次
2024-05-03更新
|
226次组卷
|
2卷引用:湖南省常德市石门县第一中学2023-2024学年高二下学期高考科目化学期中考试题
名校
4 . NH3具有易液化、含氢密度高、应用广泛等优点,NH3的合成及应用一直是科学研究的重要课题。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为_____ 。
②我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是_____ 。
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是_____ 。
②NaHCO3分解得Na2CO3., 空间结构为
空间结构为_____ 。
(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
①NH3的中心原子的杂化轨道类型为_____ 。
②比较熔点:NH3BH3_____ CH3CH3(填“>”或“<”)。
(4)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为_____ 。
②NH3BH3具有碱性(可与H+结合)而NF3没有碱性。原因是_____ 。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为
②我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是
②NaHCO3分解得Na2CO3.,
 空间结构为
空间结构为(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
| 元素 | H | B | N | F |
| 电负性 | 2.1 | 2.0 | 3.0 | 4.0 |
②比较熔点:NH3BH3
(4)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为
②NH3BH3具有碱性(可与H+结合)而NF3没有碱性。原因是
您最近一年使用:0次
2024-03-03更新
|
281次组卷
|
2卷引用:湖南省衡阳市衡阳县第一中学2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
5 . 我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)下列N原子的电子排布图表示的状态中,能量最高的是___________(填字母)。
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有___________ 种。
(3)Na与N形成的 可用于汽车的安全气囊中,其中阴离子的空间结构为
可用于汽车的安全气囊中,其中阴离子的空间结构为___________ ,Na在空气中燃烧发出黄色火焰,这种黄色焰色用光谱仪摄取的光谱为___________ (填“发射”或“吸收”)光谱。
(4) 与同主族磷的氢化物
与同主族磷的氢化物 键角大小比较
键角大小比较___________ ,请解释 的键角比
的键角比 的键角大的原因:
的键角大的原因:___________ 。
(1)下列N原子的电子排布图表示的状态中,能量最高的是___________(填字母)。
A. | B. |
C. | D. |
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有
(3)Na与N形成的
 可用于汽车的安全气囊中,其中阴离子的空间结构为
可用于汽车的安全气囊中,其中阴离子的空间结构为(4)
 与同主族磷的氢化物
与同主族磷的氢化物 键角大小比较
键角大小比较 的键角比
的键角比 的键角大的原因:
的键角大的原因:
您最近一年使用:0次
2023-12-23更新
|
350次组卷
|
2卷引用:湖南省张家界市民族中学2023-2024学年高二上学期期中考试化学试题
名校
6 . 2022年10月5日,诺贝尔化学奖表彰了“为点击化学和生物正交化学的发展”做出突出贡献的三位化学科学家,重庆大学有研究者指出,“点击化学或生物正交化学很多都基于叠氮(三个氮原子连接在一起)”,已知反应: ,下列有关说法正确的是
,下列有关说法正确的是
 ,下列有关说法正确的是
,下列有关说法正确的是A. 为离子化合物,含有离子键和极性共价键 为离子化合物,含有离子键和极性共价键 |
| B.上述反应涉及的元素中第一电离能最大的是O |
C.基态O原子价层电子排布图为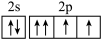 |
D. 的VSEPR模型为正四面体形 的VSEPR模型为正四面体形 |
您最近一年使用:0次
2023-07-12更新
|
164次组卷
|
4卷引用:湖南省张家界市民族中学2023-2024学年高二上学期期中考试化学试题
7 . 下列叙述正确的是
| A.Na、Mg、Al的第一电离能逐渐增大 |
| B.N、O、F的电负性逐渐增大 |
| C.根据物质的溶解性“相似相溶“原理,可以用酒精提取碘水中的碘 |
| D.含有极性键的分子一定是极性分子 |
您最近一年使用:0次
2023-05-01更新
|
147次组卷
|
2卷引用:湖南省长沙市实验中学2022-2023学年高二下学期期中考试化学试题
8 . 已知M、X、Y、Z、N为原子序数依次增大的短周期主族元素,M和N的价层电子排布式都满足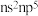 ,化合物
,化合物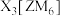 可作为冶炼金属Z的助熔剂,其结构式如图所示,该化合物下列有关叙述错误的是
可作为冶炼金属Z的助熔剂,其结构式如图所示,该化合物下列有关叙述错误的是

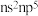 ,化合物
,化合物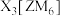 可作为冶炼金属Z的助熔剂,其结构式如图所示,该化合物下列有关叙述错误的是
可作为冶炼金属Z的助熔剂,其结构式如图所示,该化合物下列有关叙述错误的是
A.物质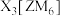 属于配合物 属于配合物 | B.晶体的熔点: |
C.M、X、N对应离子半径: | D.第一电离能: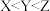 |
您最近一年使用:0次
9 . 二氧化碳化学资源化利用已经显示出越来越重要的科技与经济价值,如用铜锌氧化物催化二氧化碳加氢生成 ,合成碳酸乙烯酯(
,合成碳酸乙烯酯(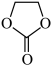 )等。回答下列问题:
)等。回答下列问题:
(1)基态铜原子价电子排布式为_______ ;第二电离能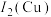
_______ 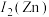 。
。
(2)碳酸乙烯酯中碳原子杂化方式为_______ ,每个分子中含_______ 个 键。
键。
(3) 加氢得到
加氢得到 ,
, 的沸点比
的沸点比 的高,原因是
的高,原因是_______ 。
(4)高温时,太阳能反应器中的 失去部分氧,温度稍低时,从
失去部分氧,温度稍低时,从 中重新夺取氧。
中重新夺取氧。 的晶胞结构如图所示:
的晶胞结构如图所示:
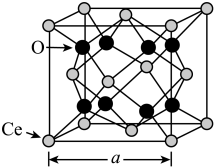
①Ce的配位数为_______ 。
②若高温下该晶胞中1个氧原子变为空位,_______ 个面心上的Ce由 价变为
价变为 价(顶点上的Ce化合价不变)。
价(顶点上的Ce化合价不变)。
③已知 的密度为
的密度为 ,设
,设 为阿伏加德罗常数的值,则晶胞边长
为阿伏加德罗常数的值,则晶胞边长
_______ pm(列出计算式即可)。
 ,合成碳酸乙烯酯(
,合成碳酸乙烯酯( )等。回答下列问题:
)等。回答下列问题:(1)基态铜原子价电子排布式为
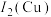
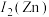 。
。(2)碳酸乙烯酯中碳原子杂化方式为
 键。
键。(3)
 加氢得到
加氢得到 ,
, 的沸点比
的沸点比 的高,原因是
的高,原因是(4)高温时,太阳能反应器中的
 失去部分氧,温度稍低时,从
失去部分氧,温度稍低时,从 中重新夺取氧。
中重新夺取氧。 的晶胞结构如图所示:
的晶胞结构如图所示:
①Ce的配位数为
②若高温下该晶胞中1个氧原子变为空位,
 价变为
价变为 价(顶点上的Ce化合价不变)。
价(顶点上的Ce化合价不变)。③已知
 的密度为
的密度为 ,设
,设 为阿伏加德罗常数的值,则晶胞边长
为阿伏加德罗常数的值,则晶胞边长
您最近一年使用:0次
名校
10 . 一种由短周期主族元素组成的化合物(如图所示)在电化学领域有重要应用。已知X、Y、Z、W、T的原子序数依次增大且为同周期,X和Y的核外电子数之和等于W的核外电子数。下列说法正确的是

| A.简单氢化物的沸点:W>T>Z |
| B.离子半径由大到小的顺序为:T>W>X |
| C.同周期中第一电离能小于W的元素有5种 |
| D.化合物中所有原子均满足8电子稳定结构 |
您最近一年使用:0次
2023-04-13更新
|
286次组卷
|
4卷引用:湖南省多校联考2022-2023学年高二下学期期中考试化学试题



