名校
1 . 回答下列问题
(1)现有5种元素A、B、C、D、E,其中有3种金属元素,1种稀有气体元素,其I1~I3分别如下表。
根据表中数据判断其中的金属元素为___________ ,稀有气体元素为___________ ,显正二价的金属元素是___________ 。(填字母)
(2)水分子是H2O而不是H3O,是因为共价键具有___________ 性;水分子的键角为105°,是因为共价键具有___________ 性。
(3)1mol乙酸分子CH3COOH中含有的π键与σ键的数目之比为___________ 。
(4)已知NH5为离子化合物,则1molNH5晶体中含有的共价键数目为___________ 。
(1)现有5种元素A、B、C、D、E,其中有3种金属元素,1种稀有气体元素,其I1~I3分别如下表。
| 元素 | I1/eV | I2/eV | I3/eV |
| A | 13.0 | 23.9 | 40.0 |
| B | 4.3 | 31.9 | 47.8 |
| C | 5.7 | 47.4 | 71.8 |
| D | 7.7 | 15.1 | 80.3 |
| E | 21.6 | 41.1 | 65.2 |
(2)水分子是H2O而不是H3O,是因为共价键具有
(3)1mol乙酸分子CH3COOH中含有的π键与σ键的数目之比为
(4)已知NH5为离子化合物,则1molNH5晶体中含有的共价键数目为
您最近一年使用:0次
2 . 回答下列问题:
(1)化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有_____ 。

A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C-C-C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(2)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物III相比,水溶性较好的是_____ 。
(3)NH3、PH3、AsH3分子的键角分别为107.3°、93.3°、91.8°,其键角逐渐减小的原因是____ 。
(4) 中含有各元素的电负性由小到大的顺序为
中含有各元素的电负性由小到大的顺序为____ ;该物质中,含有σ键和π键数目之比为____ 。
(5)在CO分子中每个原子均为8电子稳定结构,则C与O之间形成_____ 个σ键____ 个π键,在这些化学键中,O原子共提供了____ 个电子。
(6)乙腈(CH3CN)分子中碳原子的杂化类型有____ ,与N同周期的主族元素中,第一电离能大于N的有_____ 种,写出一种与N 互为等电子体的分子的化学式
互为等电子体的分子的化学式_____ ,NO 离子的立体构型是
离子的立体构型是____ 。
(7)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于表:
锰元素位于第四周期第VIIB族。请写出基态Mn2+的价电子排布式:_____ ,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是_____ 。
(1)化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有

A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C-C-C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(2)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物III相比,水溶性较好的是
(3)NH3、PH3、AsH3分子的键角分别为107.3°、93.3°、91.8°,其键角逐渐减小的原因是
(4)
 中含有各元素的电负性由小到大的顺序为
中含有各元素的电负性由小到大的顺序为(5)在CO分子中每个原子均为8电子稳定结构,则C与O之间形成
(6)乙腈(CH3CN)分子中碳原子的杂化类型有
 互为等电子体的分子的化学式
互为等电子体的分子的化学式 离子的立体构型是
离子的立体构型是(7)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于表:
| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
您最近一年使用:0次
解题方法
3 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为_______ 。
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是_______ 。I1(Be)>I1(B)>I1(Li),原因是_______ 。
(3)磷酸根离子的空间构型为_______ ,其中P的价层电子对数为_______ 、杂化轨道类型为_______ 。
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是
(3)磷酸根离子的空间构型为
您最近一年使用:0次
4 . 在下列空格中,填上适当的元素符号。
(1)在第3周期中,第一电离能最小的元素是_______ ,第一电离能最大的元素是_______ 。
(2)在元素周期表中,电负性最大的元素是_______ ,电负性最小的元素是_______ 。
(3)在第4周期元素中,原子的4p轨道半充满的是_______ ,3d轨道半充满的_______ ,4s轨道半充满的是_______ ,外围电子中s电子数与d电子数相同的是_______ 。
(1)在第3周期中,第一电离能最小的元素是
(2)在元素周期表中,电负性最大的元素是
(3)在第4周期元素中,原子的4p轨道半充满的是
您最近一年使用:0次
2022-11-25更新
|
1026次组卷
|
3卷引用:苏教2020版选择性必修2专题2第二单元 元素性质的递变规律课后习题
5 . 按要求回答下列问题:
(1)研究发现,在CO2低压合成甲醇反应CO2+3H2=CH3OH+H2O中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布为___________ ;元素Mn与O中,第一电离能较大的是___________ ,基态原子核外未成对电子数较多的是___________ 。
(2)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl。
①氮原子的价层电子排布图为___________ 。
②元素的基态的气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1),第二周期部分元素的E1变化趋势如图所示。
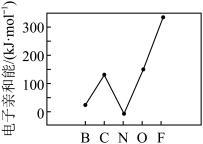
其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________ ,氮元素E1呈现异常的原因是___________ 。
(1)研究发现,在CO2低压合成甲醇反应CO2+3H2=CH3OH+H2O中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布为
(2)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl。
①氮原子的价层电子排布图为
②元素的基态的气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1),第二周期部分元素的E1变化趋势如图所示。

其中除氮元素外,其他元素的E1自左而右依次增大的原因是
您最近一年使用:0次
2022-10-20更新
|
210次组卷
|
10卷引用:考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)
(已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)广东省东莞市新世纪英才学校2021-2022学年高二上学期第一次教学质量检测化学试题(已下线)第1章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)湖北省咸宁市嘉鱼县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)第一章 本章达标检测2河北省石家庄市第23中学2022-2023学年高二上学期第一次月考化学试题常州市武进区礼嘉中学2021-2022学年高二下学期第二次阶段测试化学试题湖南省衡阳县第四中学 2022-2023学年高二下学期开学摸底考试(平行班)化学试题(已下线)第一章 原子结构与性质(B卷)
6 . 请用符号“>”“<”“=”填空:
(1)酸性:醋酸(CH3COOH)____ 丙酸(CH3CH2COOH)。
(2)键角:NH3____ SiH4。
(3)第一电离能:P____ S。
(4)电负性:S____ P。
(5)半径:Na+____ Al3+。
(1)酸性:醋酸(CH3COOH)
(2)键角:NH3
(3)第一电离能:P
(4)电负性:S
(5)半径:Na+
您最近一年使用:0次
解题方法
7 . 第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。如图是部分元素原子的第一电离能I1随原子序数变化的曲线图。请回答以下问题:
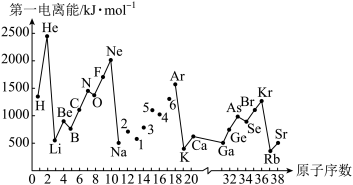
(1)认真分析图中同周期元素第一电离能的变化规律,将Na—Ar之间六种元素用短线连接起来,构成完整的图象____ 。
(2)从图分析可知,同一主族元素原子第一电离能I1变化规律____ 。
(3)图中5号元素在周期表中的位置是____ 、电子排布____ 。
(4)图中N元素比O元素第一电离能高的原因是____ 。
(5)C、H元素形成的化合物分子中共有14个电子,该分子中____ 个σ键,____ 个π键,中心原子杂化模式____ ,分子空间构型____ 。

(1)认真分析图中同周期元素第一电离能的变化规律,将Na—Ar之间六种元素用短线连接起来,构成完整的图象
(2)从图分析可知,同一主族元素原子第一电离能I1变化规律
(3)图中5号元素在周期表中的位置是
(4)图中N元素比O元素第一电离能高的原因是
(5)C、H元素形成的化合物分子中共有14个电子,该分子中
您最近一年使用:0次
名校
8 . 合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为___________ ,占据最高能级电子的电子云轮廓图为___________ 形。
②NH3分子中,与N原子相连的H显正电性。N、H电负性大小顺序为___________ 。
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是___________ 。
②比较Mg、Ca第一电离能的大小:___________ 。O的第一电离能小于N,原因是___________ 。
③下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
结合数据说明Mg的常见化合价为+2价的原因:___________ 。
(3)我国科研人员研制出了“Fe—LiH”催化剂,温度、压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的核外电子排布式为___________ ,铁在元素周期表中的位置___________ 。
②比较Li+与H-的半径大小关系:r(Li+)___________ r(H-)(填“>”或“<”)。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为
②NH3分子中,与N原子相连的H显正电性。N、H电负性大小顺序为
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是
②比较Mg、Ca第一电离能的大小:
③下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
| 元素 | Na | Mg | Al |
| 电离能(kJ/mol) | 496 | 738 | 578 |
| 4562 | 1451 | 1817 | |
| 6912 | 7733 | 2745 | |
| 9543 | 10540 | 11575 |
(3)我国科研人员研制出了“Fe—LiH”催化剂,温度、压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的核外电子排布式为
②比较Li+与H-的半径大小关系:r(Li+)
您最近一年使用:0次
2022-03-15更新
|
800次组卷
|
4卷引用:北京师范大学附属中学2021-2022学年高二上学期期末考试化学试题
9 . NH3在工农业生产中具有重要的作用,可以用来生产尿素(结构简式为: )等化学肥料,也可以用来制备一些配位化合物。
)等化学肥料,也可以用来制备一些配位化合物。
(1)合成氨是人类科学技术上的一项重大突破,工业合成氨生产中常用铁触媒作催化剂。请写出Fe元素的基态原子的电子排布式:_______ 。
(2)工业上生产尿素的化学反应: ,则CO(NH2)2分子中C原子的杂化方式为
,则CO(NH2)2分子中C原子的杂化方式为_______ 。C、N、O三种元素的第一电离能由小到大的顺序为_______ 。
(3)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的 晶体,与该物质中的配体互为等电子体的阴离子的化学式为
晶体,与该物质中的配体互为等电子体的阴离子的化学式为_______ 。
(4)写出将过量氨水缓慢滴入硫酸铜溶液中发生反应的离子方程式:_______ 、_______ 。
 )等化学肥料,也可以用来制备一些配位化合物。
)等化学肥料,也可以用来制备一些配位化合物。(1)合成氨是人类科学技术上的一项重大突破,工业合成氨生产中常用铁触媒作催化剂。请写出Fe元素的基态原子的电子排布式:
(2)工业上生产尿素的化学反应:
 ,则CO(NH2)2分子中C原子的杂化方式为
,则CO(NH2)2分子中C原子的杂化方式为(3)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的
 晶体,与该物质中的配体互为等电子体的阴离子的化学式为
晶体,与该物质中的配体互为等电子体的阴离子的化学式为(4)写出将过量氨水缓慢滴入硫酸铜溶液中发生反应的离子方程式:
您最近一年使用:0次
解题方法
10 . 根据已学知识,回答下列问题:
(1)基态N原子中,核外电子占据的最高能层的符号是____ ,占据该能层电子的电子云轮廓图形状为____ 。
(2)写出3p轨道上有2个未成对电子的元素的符号____ 或____ 。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布式为4s24p4,该元素的名称是____ 。
(4)已知铁是26号元素,写出Fe的价层电子排布式____ ;在元素周期表中,该元素在____ (填“s”“p”“d”“f”或“ds”)区。
(5)写出与N同主族的As的基态原子的核外电子排布式____ 。
(6)从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为____ 。
(7)写出Fe2+的核外电子排布式:____ 。
(8)Zn2+的核外电子排布式为____ 。
(1)基态N原子中,核外电子占据的最高能层的符号是
(2)写出3p轨道上有2个未成对电子的元素的符号
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布式为4s24p4,该元素的名称是
(4)已知铁是26号元素,写出Fe的价层电子排布式
(5)写出与N同主族的As的基态原子的核外电子排布式
(6)从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为
(7)写出Fe2+的核外电子排布式:
(8)Zn2+的核外电子排布式为
您最近一年使用:0次



