解题方法
1 . 一种阴离子的结构如图所示,X、Y、Z、W为原子序数依次增大的短周期元素,基态W原子中有3个未成对电子,下列说法正确的是
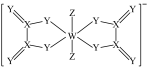
A.电负性: | B.简单氢化物的沸点: |
C.最高价氧化物对应水化物的酸性: | D.单质的氧化性: |
您最近一年使用:0次
2 . 一般认为,含氧酸酸性强弱主要与两个因素有关:一是中心原子的电负性越大,酸性越强:一是中心原子所连接的“非羟基氧”数目越多,酸性越强。据此推断下列说法正确的是
A. 是一种二元强酸 是一种二元强酸 |
B.H3PO2的分子结构是 ,它是一种三元弱酸 ,它是一种三元弱酸 |
| C.HPO3、 HClO3、HClO4的酸性依次增强 |
D.某元素X形成的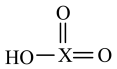 比HO-X的酸性强,氧化性也强 比HO-X的酸性强,氧化性也强 |
您最近一年使用:0次
2022-05-27更新
|
922次组卷
|
3卷引用:山东省名校联盟2022届高三下学期5月模拟考试化学试题
3 . 2016年中国科学家成功合成NiO/TiO2电解水催化剂和新型高效的钙钛矿太阳能电池,为解决能源危机保护环境作出了重大贡献。请回答下列问题:
(1)TiO2与焦炭、Cl2在高温下反应的化学方程式为:TiO2+2C+2Cl2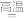 TiCl4+2CO。
TiCl4+2CO。
①基态钛原子的价电子排布式为_________________ 。
②该反应中涉及到的非金属元素的电负性大小顺序为_______________________ 。
(2)已知NiO/TiO2催化化合物甲生成化合物乙的过程如图所示:
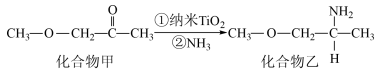
化合物甲的沸点小于化合物乙的沸点,主要原因是___________________ 。在化合物乙中,氧原子的杂化方式是______________ 。
(3)CH3NH3+、Ti4+、Pb2+、Cl-等离子是组成新型钙钛矿太阳能电池的主要离子。CH3NH3+离子中H—N—H键的键角比NH3分子中H—N—H键的键角______ (填“大”或“小”),原因是_____________ 。
(4)Sb(锑)和Ga(镓)的卤化物有很多用途。一定条件下将SbCl3与GaCl3以物质的量之比为l:l反应得到一种固态离子化合物,有人提出了以下两种结构。你认为下列关于结构和说法中合理的是____ 。
a. [SbCl2+][GaCl4-] b. [GaCl2+][SbCl4-] c. 没有相关资料,无法判断
(5)金属钛晶胞(如图1所示)中有若干个正四面体空隙,图1中a、b、c、d四个钛原子形成的正四面体其内部空隙中可以填充其他原子。
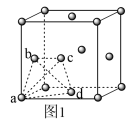
①请回答,金属钛晶胞的结构属于____________ 。
a. 简单立方 b. 体心立方 c. 面心立方 d. 金刚石型
②若晶胞中所有的正四面体空隙中都填充氢原子,那么形成的氢化钛的化学式为______________ 。
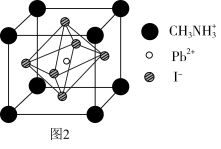
(6)某钙钛矿太阳能电池材料的晶胞如图2所示,其晶胞参数为d pm、密度为ρ g·cm-3。则该晶体的摩尔质量________ g·mol-1。(用含d、ρ等符号的式子表示,用NA表示阿伏加 德罗常数的值)
(1)TiO2与焦炭、Cl2在高温下反应的化学方程式为:TiO2+2C+2Cl2
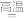 TiCl4+2CO。
TiCl4+2CO。①基态钛原子的价电子排布式为
②该反应中涉及到的非金属元素的电负性大小顺序为
(2)已知NiO/TiO2催化化合物甲生成化合物乙的过程如图所示:

化合物甲的沸点小于化合物乙的沸点,主要原因是
(3)CH3NH3+、Ti4+、Pb2+、Cl-等离子是组成新型钙钛矿太阳能电池的主要离子。CH3NH3+离子中H—N—H键的键角比NH3分子中H—N—H键的键角
(4)Sb(锑)和Ga(镓)的卤化物有很多用途。一定条件下将SbCl3与GaCl3以物质的量之比为l:l反应得到一种固态离子化合物,有人提出了以下两种结构。你认为下列关于结构和说法中合理的是
a. [SbCl2+][GaCl4-] b. [GaCl2+][SbCl4-] c. 没有相关资料,无法判断
(5)金属钛晶胞(如图1所示)中有若干个正四面体空隙,图1中a、b、c、d四个钛原子形成的正四面体其内部空隙中可以填充其他原子。

①请回答,金属钛晶胞的结构属于
a. 简单立方 b. 体心立方 c. 面心立方 d. 金刚石型
②若晶胞中所有的正四面体空隙中都填充氢原子,那么形成的氢化钛的化学式为

(6)某钙钛矿太阳能电池材料的晶胞如图2所示,其晶胞参数为d pm、密度为ρ g·cm-3。则该晶体的摩尔质量
您最近一年使用:0次
4 . 短周期元素X、Y、Z原子半径的顺序为Z>X>Y,基态X原子p能级上的电子数是Y原子质子数的3倍,它们可以形成离子化合物 ,其中阳离子
,其中阳离子 (已知
(已知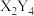 水合物的
水合物的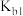 为
为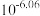 、
、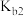 为
为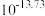 )的结构如图所示。下列叙述错误的是
)的结构如图所示。下列叙述错误的是

 ,其中阳离子
,其中阳离子 (已知
(已知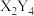 水合物的
水合物的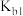 为
为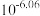 、
、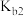 为
为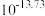 )的结构如图所示。下列叙述错误的是
)的结构如图所示。下列叙述错误的是
A.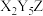 的阴、阳离子均含有18个电子 的阴、阳离子均含有18个电子 |
B.常温下,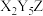 的水溶液呈碱性 的水溶液呈碱性 |
| C.三种元素中Y的电负性最小 |
| D.简单气态氢化物的还原性:X>Z |
您最近一年使用:0次
名校
解题方法
5 . 氮族元素可以形成多种多样的化合物,回答下列问题:
(1)基态As原子的价电子的轨道表示式是______ 。
(2)叠氮酸(HN3)常用于引爆剂,可用联氨( )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
______ 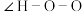 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: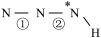 ,
, 为
为 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①______ ②。
(3)乙胺( )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是______ 。
(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是______ 。

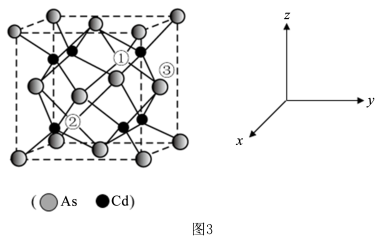
(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为 ,晶胞参数为
,晶胞参数为 ,
, 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是______ ,n原子的分数坐标是______ ,若阿伏加德罗常数值为 ,该晶体密度是
,该晶体密度是______  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态As原子的价电子的轨道表示式是
(2)叠氮酸(HN3)常用于引爆剂,可用联氨(
 )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
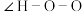 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: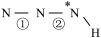 ,
, 为
为 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①(3)乙胺(
 )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为
 ,晶胞参数为
,晶胞参数为 ,
, 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是 ,该晶体密度是
,该晶体密度是 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-05-21更新
|
451次组卷
|
2卷引用:山东省潍坊市2024届高三下学期二模化学试题
6 . 前四周期元素X、Y、Z、W的原子序数依次增大,X原子中有6个运动状态不同的电子,Y是地壳中含量最多的元素,基态Z原子K、L层上的电子总数是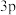 原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是
原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是
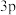 原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是
原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是A.电负性: ,原子半径: ,原子半径: | B.同周期中,元素Z的第一电离能最大 |
C.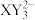 离子中存在 离子中存在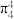 的离域π键 的离域π键 | D.在一定条件下,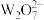 和 和 均具有强氧化性 均具有强氧化性 |
您最近一年使用:0次
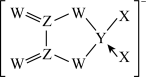
7 . 化合物R是一种用于有机合成的催化剂,其网状结构片段如图。X、Y、Z、W为原子序数依次增大的短周期主族元素,四种元素原子序数之和为29,W的第一电离能大于同周期相邻元素。下列说法正确的是
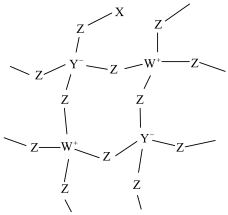

| A.电负性:W>Y>X |
B. 中各原子均满足8电子稳定结构 中各原子均满足8电子稳定结构 |
| C.同周期元素形成的单质中,Z的氧化性最强 |
| D.化合物R中Y、Z、W原子的杂化类型相同 |
您最近一年使用:0次
8 . 石墨烯、高温氯化钠、砷化镉等超导材料应用广泛。回答下列问题:
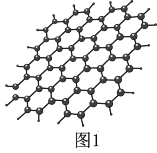
(1)石墨烯结构如图1所示,则碳原子的杂化方式为_______ ,12 g石墨烯中含有六元环个数与σ键个数之比为_______ 。
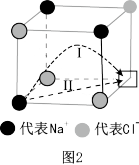
(2)温度升高时,NaCl晶体出现缺陷,如图2方格处填入Na+时,恰好构成氯化钠晶胞的 ,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径
,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径_______ (填图中序号)迁移到空位处。
(3)石墨烯限域单原子铁催化剂使CH4在室温条件下被H2O2直接氧化为HCHO、HCOOH,比较HCHO、HCOOH的沸点高低并说明理由_______ 。
(4)镉(Cd)与Zn同族且相邻,则基态Cd原子的价电子排布式为_______ ;与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3强于PH3,原因是_______ 。
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构为正方体如图3, 占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为(
占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为( ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为_______ 。晶胞的密度为 ,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为
,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为_______ pm(列计算式即可)。
(1)石墨烯结构如图1所示,则碳原子的杂化方式为

(2)温度升高时,NaCl晶体出现缺陷,如图2方格处填入Na+时,恰好构成氯化钠晶胞的
 ,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径
,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径
(3)石墨烯限域单原子铁催化剂使CH4在室温条件下被H2O2直接氧化为HCHO、HCOOH,比较HCHO、HCOOH的沸点高低并说明理由
(4)镉(Cd)与Zn同族且相邻,则基态Cd原子的价电子排布式为
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构为正方体如图3,
 占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为(
占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为( ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为 ,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为
,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为
您最近一年使用:0次
2022-03-29更新
|
699次组卷
|
4卷引用:山东省聊城市2021-2022学年下学期高三一模化学试题
山东省聊城市2021-2022学年下学期高三一模化学试题(已下线)必刷卷02-2022年高考化学考前信息必刷卷(山东专用)(已下线)必刷卷05-2022年高考化学考前信息必刷卷(河北专用)河北省石家庄市第二中学2022届高三2.5模化学试题
名校
9 . 短周期元素X、Y、Z、W位于同一周期,W元素的某种单质具有强氧化性,可用于杀菌消毒。四种元素组成的一种离子结构如图所示。下列说法错误的是
| A.电负性:Y<Z<W<X |
| B.简单氢化物的熔沸点:Z<X |
| C.Y的最高价氧化物的水化物为强酸 |
| D.阴离子中各原子均满足最外层8电子稳定结构 |
您最近一年使用:0次
2022-04-16更新
|
904次组卷
|
5卷引用:山东省枣庄市2022届高三第二次模拟化学试题
名校
10 . 短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法不正确的是( )

| A.Y、Z、W三种元素电负性:W>Z>Y |
| B.Y、Z、W三种元素的第一电离能:W>Z>Y |
| C.Y、Z、W与氢元素均可形成含非极性键的二元化合物 |
| D.由X、Y、Z、W构成的化合物中可能含有离子键 |
您最近一年使用:0次
2020-11-25更新
|
489次组卷
|
5卷引用:山东省济南市第一中学2021届高三上学期期中考试化学试题



