1 . 回答下列问题:
(1)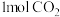 中含有的
中含有的 键数目为
键数目为___________ , 键数目为
键数目为___________ 。
(2)已知CO和 与
与 结构相似,CO分子内
结构相似,CO分子内 键与
键与 键个数之比为
键个数之比为___________ 。 分子中
分子中 键与
键与 键数目之比为
键数目之比为___________ 。
(3)肼 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被 (氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
(氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
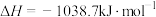 ,若该反应中有
,若该反应中有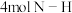 键断裂,则形成的
键断裂,则形成的 键有
键有___________ mol。
(4)Co基态原子核外电子排布式为___________ ; 的价电子轨道表示式为
的价电子轨道表示式为___________ ; 核外电子未成对电子数为
核外电子未成对电子数为___________ 。
(5) 、
、 、
、 、
、 分子中共价键的极性由强到弱的顺序是
分子中共价键的极性由强到弱的顺序是___________ 。
(1)
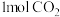 中含有的
中含有的 键数目为
键数目为 键数目为
键数目为(2)已知CO和
 与
与 结构相似,CO分子内
结构相似,CO分子内 键与
键与 键个数之比为
键个数之比为 分子中
分子中 键与
键与 键数目之比为
键数目之比为(3)肼
 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被 (氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
(氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
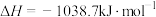 ,若该反应中有
,若该反应中有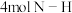 键断裂,则形成的
键断裂,则形成的 键有
键有(4)Co基态原子核外电子排布式为
 的价电子轨道表示式为
的价电子轨道表示式为 核外电子未成对电子数为
核外电子未成对电子数为(5)
 、
、 、
、 、
、 分子中共价键的极性由强到弱的顺序是
分子中共价键的极性由强到弱的顺序是
您最近一年使用:0次
2024-04-27更新
|
63次组卷
|
2卷引用:黑龙江省绥化市绥棱县第一中学2023-2024学年高二上学期1月期末化学试题
解题方法
2 . 尿素[ ]是一种重要的工业原料,在160℃下分解生成异氰酸和氨气,化学方程式为
]是一种重要的工业原料,在160℃下分解生成异氰酸和氨气,化学方程式为 。回答下列问题:
。回答下列问题:
(1)上述反应所涉及的各元素中,原子半径最大的是___________ (填元素符号),其原子核外电子共占据___________ 个原子轨道。
(2)上述元素中有三种元素处于同周期,则:
①最高价氧化物对应水化物的酸性最强的是___________ (填化学式)。
②元素的第一电离能由大到小的顺序是___________ (填元素符号,下同)。
③元素的电负性由大到小的顺序是___________ 。
(3)氰酸有两种结构,一种分子内含有三键,称为氰酸,另一种分子内不含三键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。写出氰酸和异氰酸的结构式:___________ 、___________ 。
 ]是一种重要的工业原料,在160℃下分解生成异氰酸和氨气,化学方程式为
]是一种重要的工业原料,在160℃下分解生成异氰酸和氨气,化学方程式为 。回答下列问题:
。回答下列问题:(1)上述反应所涉及的各元素中,原子半径最大的是
(2)上述元素中有三种元素处于同周期,则:
①最高价氧化物对应水化物的酸性最强的是
②元素的第一电离能由大到小的顺序是
③元素的电负性由大到小的顺序是
(3)氰酸有两种结构,一种分子内含有三键,称为氰酸,另一种分子内不含三键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。写出氰酸和异氰酸的结构式:
您最近一年使用:0次
名校
解题方法
3 . 下列曲线表示第ⅦA族元素(F、 、I)性质随其质子数的变化趋势,错误的是
、I)性质随其质子数的变化趋势,错误的是
 、I)性质随其质子数的变化趋势,错误的是
、I)性质随其质子数的变化趋势,错误的是A.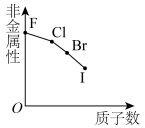 | B. |
C.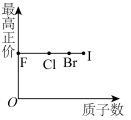 | D.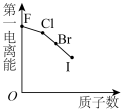 |
您最近一年使用:0次
2023-12-26更新
|
233次组卷
|
7卷引用:黑龙江省绥化市绥棱县第一中学2023-2024学年高二下学期开学化学试题
黑龙江省绥化市绥棱县第一中学2023-2024学年高二下学期开学化学试题青海省海南州高级中学、共和县高级中学2023-2024学年高二上学期期中联考化学试题山东省菏泽市鄄城县第一中学2023-2024学年高二上学期1月期末化学试题江西省部分学校2023-2024学年高二上学期1月期末化学试题(已下线)1.2.2 元素周期律(基础)(已下线)名校期中好题汇编-原子结构与性质(选择题)名校期中好题汇编-原子结构与性质(选择题)
解题方法
4 . Q、W、X、Y、Z五种短周期元素的原子半径依次增大,基态Q原子的电子填充了3个能级,有4对成对电子,Z与其他元素不在同一周期,五种元素可构成某种离子液体的阴离子如图所示。下列说法正确的是
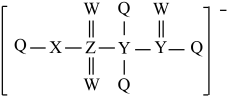
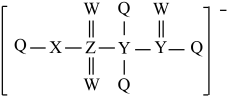
| A.Y 形成的含氧酸均不能使高锰酸钾褪色 | B.Q和W形成的化合物中W为正价 |
| C.基态Z原子核外有3种能量不同的电子 | D.氢化物沸点: W>Q>X>Y |
您最近一年使用:0次
2023-10-29更新
|
795次组卷
|
3卷引用:黑龙江省肇东市第四中学校2023-2024学年高三上学期第二次月考化学试卷
黑龙江省肇东市第四中学校2023-2024学年高三上学期第二次月考化学试卷内蒙古自治区赤峰市2024届高三上学期10月一轮复习大联考化学试题(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
5 . 某化学兴趣小组对BeCl2是离子化合物还是共价化合物进行探究,从经验看铍是金属元素,易失去电子,氯是非金属元素,易得到电子。
(1)查表得知,Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为_______ (填“离子”或“共价”)化合物。
(2)工业上制取BeCl2的方法是将得到的BeCl2溶液在HCl气流中蒸干灼烧,防止BeCl2水解,请写出BeCl2水解的化学方程式:_______ 。
(3)经实验验证,熔融的BeCl2不能导电,说明它是_______ (填“离子”或“共价”)化合物;BeCl2能溶于水,水溶液能导电,是因为它在溶液中能电离,写出它的电离方程式:_______ 。
(4)在周期表中,铍元素和铝元素恰好处于对角线位置,根据对角线法则,BeCl2应与_______ (填“MgCl2”或“AlCl3”)的化学性质更相似。
(5)氢氧化铍能与氢氧化钠溶液发生反应,写出该反应的化学方程式:_______ 。
(1)查表得知,Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为
(2)工业上制取BeCl2的方法是将得到的BeCl2溶液在HCl气流中蒸干灼烧,防止BeCl2水解,请写出BeCl2水解的化学方程式:
(3)经实验验证,熔融的BeCl2不能导电,说明它是
(4)在周期表中,铍元素和铝元素恰好处于对角线位置,根据对角线法则,BeCl2应与
(5)氢氧化铍能与氢氧化钠溶液发生反应,写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
6 . 氮、氧是两种重要的元素,下列关于这两种元素的性质描述错误的是
| A.第一电离能N>O | B.电负性O>N |
| C.简单氢化物的稳定性O>N | D.氢化物的沸点N>O |
您最近一年使用:0次
2022-03-18更新
|
100次组卷
|
2卷引用:黑龙江省绥化市第九中学2021-2022学年高二4月月考化学试题
7 . 硅是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态硅(Si)原子的核外电子排布式为[Ne]_______ ,有_______ 个未成对电子。
(2)碳(C)、硅(Si)、锗(Ge)是同族元素。
①基态Ge原子的核外电子占据_______ 个能层、_______ 个能级。
②上述三种元素的电负性由大到小的顺序为_______ (填元素符号)。
③固态CO2可用于人工降雨,SiO2常用于_______ (填一种即可)。
④请写出高温条件下碳和二氧化硅反应的化学方程式:_______ 。
(3)在元素周期表中,某些元素与其右下方的主族元素(如图所示)的一些性质是相似的。如Si与NaOH反应生成Na2SiO3和H2,则B与NaOH反应生成_______ (填化学式)和H2。
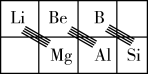
(1)基态硅(Si)原子的核外电子排布式为[Ne]
(2)碳(C)、硅(Si)、锗(Ge)是同族元素。
①基态Ge原子的核外电子占据
②上述三种元素的电负性由大到小的顺序为
③固态CO2可用于人工降雨,SiO2常用于
④请写出高温条件下碳和二氧化硅反应的化学方程式:
(3)在元素周期表中,某些元素与其右下方的主族元素(如图所示)的一些性质是相似的。如Si与NaOH反应生成Na2SiO3和H2,则B与NaOH反应生成

您最近一年使用:0次
2022-01-27更新
|
325次组卷
|
3卷引用:黑龙江省哈尔滨师范大学青冈实验中学校2021-2022学年高二下学期开学考试化学试题
名校
解题方法
8 . 下列有关比较中错误的是
| A.元素的电负性:N<O<F | B.元素的金属性:Na>Mg>Al |
| C.元素的第一电离能:C<N<O | D.元素的最高正价:P<S<Cl |
您最近一年使用:0次
2022-01-24更新
|
182次组卷
|
5卷引用:黑龙江省绥化市绥棱县第一中学2022-2023学年高二上学期期中考试化学试题
名校
9 . 下列各组元素性质的叙述中,正确的是
| A.第一电离能:C<N<O<F |
| B.电负性:C<N<O<F |
| C.最高正化合价:C<N<O<F |
| D.原子半径:O>F>Na>Mg |
您最近一年使用:0次
2021-12-14更新
|
420次组卷
|
3卷引用:黑龙江省肇东市第四中学2021-2022学年高二下学期期中考试化学试题
黑龙江省肇东市第四中学2021-2022学年高二下学期期中考试化学试题辽宁省辽河油田第二高级中学2021-2022学年高二上学期期中考试化学试题(已下线)第1.2.2讲 元素周期律-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
名校
10 . 钛及其化合物在人们的生活中起着十分重要的作用。尤其是二氧化钛、四氯化钛、钛酸钡等应用极广,回答下列问题:
(1)二氧化钛是调制白油漆的常用颜料,钛的原子结构示意图为___________ ,基态Ti4+中的核外电子占据的原子轨道数为___________ 。
(2)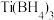 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。
①LiBH4由Li+和BH 构成,BH
构成,BH 的空间构型是
的空间构型是___________ ,B原子的杂化轨道类型是________ 。
②某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如表所示。
根据上述信息,判断M是_______ (填元素名称),该元素的简单离子核外有_______ 种运动状态不同的电子。M、O、B三种元素的电负性从大到小的顺序为___________ (填元素符号)。
(1)二氧化钛是调制白油漆的常用颜料,钛的原子结构示意图为
(2)
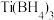 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。①LiBH4由Li+和BH
 构成,BH
构成,BH 的空间构型是
的空间构型是②某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如表所示。
| I1 / kJ·mol-1 | I2 / kJ·mol-1 | I3 / kJ·mol-1 | I4 / kJ·mol-1 | I5 / kJ·mol-1 |
| 578 | 1817 | 2745 | 11575 | 14830 |
您最近一年使用:0次
2021-12-03更新
|
150次组卷
|
2卷引用:黑龙江省肇东市第四中学2021-2022学年高二下学期期中考试化学试题



