解题方法
1 . 回答下列问题:
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气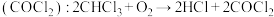 ,光气
,光气 分子的立体构型是
分子的立体构型是________ 形。
(2)某有机物的结构简式为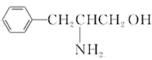 。该有机物分子是
。该有机物分子是____________ (填“极性”或“非极性”)分子,该有机物分子中采取 杂化的原子对应元素的电负性由大到小的顺序为
杂化的原子对应元素的电负性由大到小的顺序为____________ 。
(3)乙二胺 分子中氮原子杂化类型为
分子中氮原子杂化类型为_________________ 。
(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸( )是一种弱酸,其分子结构可表示为
)是一种弱酸,其分子结构可表示为 ,肼
,肼 被亚硝酸氧化时便可得到氢叠氮酸
被亚硝酸氧化时便可得到氢叠氮酸 ,发生的反应为
,发生的反应为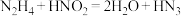 。
。 的酸性和醋酸相近,可微弱电离出
的酸性和醋酸相近,可微弱电离出 和
和 。
。
①叠氮酸根能与许多金属离子等形成配合物,如 ,根据价层电子对互斥理论判断
,根据价层电子对互斥理论判断 的空间构型为
的空间构型为________________ 。
②下列有关说法正确的是_____________ (填序号)。
A. 中含有5个
中含有5个 键
键
B. 中的三个氮原子均采用
中的三个氮原子均采用 杂化
杂化
C. 、
、 、
、 、
、 都是极性分子
都是极性分子
D.肼 的沸点高达
的沸点高达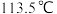 ,说明肼分子间可形成氢键
,说明肼分子间可形成氢键
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气
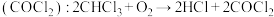 ,光气
,光气 分子的立体构型是
分子的立体构型是(2)某有机物的结构简式为
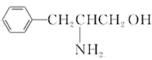 。该有机物分子是
。该有机物分子是 杂化的原子对应元素的电负性由大到小的顺序为
杂化的原子对应元素的电负性由大到小的顺序为(3)乙二胺
 分子中氮原子杂化类型为
分子中氮原子杂化类型为(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸(
 )是一种弱酸,其分子结构可表示为
)是一种弱酸,其分子结构可表示为 ,肼
,肼 被亚硝酸氧化时便可得到氢叠氮酸
被亚硝酸氧化时便可得到氢叠氮酸 ,发生的反应为
,发生的反应为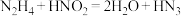 。
。 的酸性和醋酸相近,可微弱电离出
的酸性和醋酸相近,可微弱电离出 和
和 。
。①叠氮酸根能与许多金属离子等形成配合物,如
 ,根据价层电子对互斥理论判断
,根据价层电子对互斥理论判断 的空间构型为
的空间构型为②下列有关说法正确的是
A.
 中含有5个
中含有5个 键
键B.
 中的三个氮原子均采用
中的三个氮原子均采用 杂化
杂化C.
 、
、 、
、 、
、 都是极性分子
都是极性分子D.肼
 的沸点高达
的沸点高达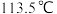 ,说明肼分子间可形成氢键
,说明肼分子间可形成氢键
您最近半年使用:0次
解题方法
2 . 下列关于元素的说法正确的是
| A.基态原子失去一个电子转化为基态正离子所需要的能量叫做第一电离能 |
| B.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 |
| C.金属的电负性小于1.8,而非金属的电负性大于1.8 |
| D.元素的电负性越大,非金属性就越强,元素原子的第一电离就越大 |
您最近半年使用:0次
解题方法
3 . 1869年门捷列夫编排的元素周期表为我们学习化学提供了理论依据。H、Li、Na、K位于周期表中ⅠA族。下列说法正确的是
| A.元素周期表的每个周期都是从ns能级开始,以mp能级结束 |
B.电负性大小: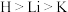 |
C.第一电离能: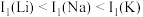 |
D.碱性强弱: |
您最近半年使用:0次
4 . 四种元素基态原子的电子排布式如下:① ;②
;② ;③
;③ ;④
;④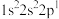 。下列有关比较中正确的是
。下列有关比较中正确的是
 ;②
;② ;③
;③ ;④
;④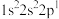 。下列有关比较中正确的是
。下列有关比较中正确的是| A.第一电离能:④>③>②>① | B.原子半径:④>③>①>② |
| C.电负性:③>④>①>② | D.最高正化合价:④=①>③=② |
您最近半年使用:0次
2024-01-24更新
|
138次组卷
|
7卷引用:陕西省西安市铁一中学2020-2021学年高二下学期期中考试化学试题
名校
解题方法
5 . 下列关于分子的结构和性质的描述错误的是
| A.碘易溶于四氯化碳溶液,甲烷难溶于水都可用“相似相溶”原理解释 |
B.硫难溶于水,微溶于酒精,易溶于 ,说明分子极性: ,说明分子极性: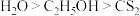 |
| C.氟的电负性大于氯的电负性,导致三氟乙酸的酸性大于三氯乙酸的酸性 |
D.乙醇分子(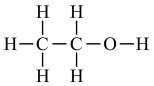 )中所有碳原子都是手性碳原子 )中所有碳原子都是手性碳原子 |
您最近半年使用:0次
名校
解题方法
6 .  四种短周期元素的原子序数依次增大,其元素基态原子的价电子排布式如下:
四种短周期元素的原子序数依次增大,其元素基态原子的价电子排布式如下:
按照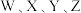 的顺序,下列各项由大到小排列的是
的顺序,下列各项由大到小排列的是
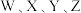 四种短周期元素的原子序数依次增大,其元素基态原子的价电子排布式如下:
四种短周期元素的原子序数依次增大,其元素基态原子的价电子排布式如下:| 元素基态原子 | W | X | Y | Z |
| 价电子排布式 | 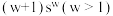 | 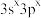 |  | 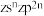 |
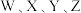 的顺序,下列各项由大到小排列的是
的顺序,下列各项由大到小排列的是| A.核电荷数 | B.电负性 | C.原子半径 | D.最高正化合价 |
您最近半年使用:0次
2023-12-24更新
|
311次组卷
|
4卷引用:陕西省西安市第八十三中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
7 . 已知:元素的电负性和元素的化合价一样,也是元素的一种基本性质;两成键元素间电负性差值大于1.7时,通常形成离子键,两成键元素间电负性差值小于1.7时,通常形成共价键。下表给出了14种元素的电负性,则下列说法错误的是
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
| A.随着原子序数递增,元素的电负性呈周期性变化 |
| B.元素电负性越大,其非金属性越强 |
| C.根据电负性数据可知Mg3N2中含有离子键 |
| D.BeCl2含金属元素铍,故属于离子化合物 |
您最近半年使用:0次
2023-07-29更新
|
96次组卷
|
6卷引用:陕西省西安交通大学附属中学2023-2024学年高二上学期期中考试化学试题
陕西省西安交通大学附属中学2023-2024学年高二上学期期中考试化学试题【全国百强校】重庆市第一中学2017-2018学年高一下学期期中考试化学试题江西省赣州市石城县石城中学2020-2021学年高一下学期3月月考化学试题(已下线)第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)第一章 本章复习提升1云南省龙陵县第一中学2022-2023学年高二下学期期末考试化学试题
名校
8 . 铁在史前就为人们所用。在人类文明发展过程中,铁所起的作用是其他任何元素都不能比拟的。请回答下列问题:
(1)基态铁原子中,价电子电子云的伸展方向有_______ 种。
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有_________ ( 填序号);
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是___________________ 。
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、 的相互作用分别为
的相互作用分别为_______________ 、_____________ 。
②比较 中的键角∠O−S−O
中的键角∠O−S−O________ H2O中的键角∠H−O−H。 (填“<” “>”或“=”)
(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是___________ 。
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为_____________________ 。

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=____________ cm3·mol−1 (已知阿伏加德罗常数为NA,晶体的摩尔体积是指单位物质的量晶体所占的体积)。
(1)基态铁原子中,价电子电子云的伸展方向有
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、
 的相互作用分别为
的相互作用分别为②比较
 中的键角∠O−S−O
中的键角∠O−S−O(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=
您最近半年使用:0次
2023-04-14更新
|
491次组卷
|
3卷引用:陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题
陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题广东省深圳市龙华中学2022-2023学年高二下学期5月期中考试化学试题(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
9 . 短周期主族元素X、Y、Z、W、M、N的原子序数依次增大,X核外电子只有1种运动状态,Y、W的 轨道均含有2个未成对电子,M是短周期原子半径最大的元素,N的氢氧化物具有两性,下列说法不正确的是
轨道均含有2个未成对电子,M是短周期原子半径最大的元素,N的氢氧化物具有两性,下列说法不正确的是
 轨道均含有2个未成对电子,M是短周期原子半径最大的元素,N的氢氧化物具有两性,下列说法不正确的是
轨道均含有2个未成对电子,M是短周期原子半径最大的元素,N的氢氧化物具有两性,下列说法不正确的是A.第一电离能: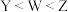 |
| B.Y的氢化物沸点不一定低于W的氢化物 |
C.电负性: |
| D.M在不同条件下与氧气反应的产物阴阳离子个数比不同 |
您最近半年使用:0次
2023-01-19更新
|
560次组卷
|
4卷引用:陕西省宝鸡市渭滨区2023-2024学年高二上学期期末考试化学试题
解题方法
10 . 氰化钾是一种剧毒物质,贮存和使用时必须注意安全。已知: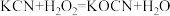 。回答下列问题:
。回答下列问题:
(1) 中所含三种元素的第一电离能从大到小的顺序为
中所含三种元素的第一电离能从大到小的顺序为_______ (用元素符号表示,下同),电负性从大到小的顺序为_______ 。
(2)与 互为等电子体的分子为
互为等电子体的分子为_______ (任举一例),其空间构型为_______ 。
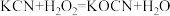 。回答下列问题:
。回答下列问题:(1)
 中所含三种元素的第一电离能从大到小的顺序为
中所含三种元素的第一电离能从大到小的顺序为(2)与
 互为等电子体的分子为
互为等电子体的分子为
您最近半年使用:0次



