名校
1 . 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布式为 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是| A.A、B、C三种元素的电负性:B>C>A |
| B.B、C、D、E四种元素的第一电离能:B>C>E>D |
C.B、C形成的化合物 为酸性氧化物 为酸性氧化物 |
D.F的常见离子的核外电子排布图为 |
您最近一年使用:0次
2024-01-08更新
|
306次组卷
|
6卷引用:山东省济南市历城第二中学2023-2024学年高二上学期期末化学模拟试题
山东省济南市历城第二中学2023-2024学年高二上学期期末化学模拟试题四川省成都石室中学2023-2024学年高二上学期期中考试化学试卷(已下线)1.2.2元素周期律-随堂练习甘肃省武威第七中学2023-2024学年高二上学期期末考试化学试题(已下线)名校期中好题汇编-原子结构与性质(选择题)名校期中好题汇编-原子结构与性质(选择题)
2 . 前四周期元素X、Y、Z、W的原子序数依次增大,X原子中有6个运动状态不同的电子,Y是地壳中含量最多的元素,基态Z原子K、L层上的电子总数是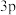 原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是
原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是
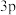 原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是
原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法错误的是A.电负性: ,原子半径: ,原子半径: | B.同周期中,元素Z的第一电离能最大 |
C.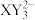 离子中存在 离子中存在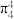 的离域π键 的离域π键 | D.在一定条件下,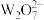 和 和 均具有强氧化性 均具有强氧化性 |
您最近一年使用:0次
3 . W、X、Y、Z为短周期主族元素,原子序数依次增大,W是地壳中含量最高的元素,X的p轨道电子总数比s轨道电子总数多1且p轨道有1个未成对电子,W的最外层电子数为Y的最外层电子数的三倍,Y、Z、W的最外层电子数成等差数列。下列叙述错误的是
| A.元素的第一电离能:Y<Z<W<X |
| B.元素的电负性Z<X且ZX4分子具有正四面体形结构 |
| C.与氢形成的共价键键能:H-W>H-X |
| D.Y与X形成的化合物为离子化合物 |
您最近一年使用:0次
2023-10-06更新
|
141次组卷
|
4卷引用:山东省部分学校2024届高三上学期10月大联考化学试题
2023·广东茂名·一模
名校
4 . 我国科学家合成了一种深紫外非线性光学晶体新材料 ,晶体中阴离子为
,晶体中阴离子为 。元素M、X、Y、Z均为短周期元素,M、Y与Z同周期,M的最外层电子数比次外层电子数多1,Z为电负性最强的元素,Y是地壳中含量最高的元素,X的
。元素M、X、Y、Z均为短周期元素,M、Y与Z同周期,M的最外层电子数比次外层电子数多1,Z为电负性最强的元素,Y是地壳中含量最高的元素,X的 轨道有3个电子。下列说法中不正确的是
轨道有3个电子。下列说法中不正确的是
 ,晶体中阴离子为
,晶体中阴离子为 。元素M、X、Y、Z均为短周期元素,M、Y与Z同周期,M的最外层电子数比次外层电子数多1,Z为电负性最强的元素,Y是地壳中含量最高的元素,X的
。元素M、X、Y、Z均为短周期元素,M、Y与Z同周期,M的最外层电子数比次外层电子数多1,Z为电负性最强的元素,Y是地壳中含量最高的元素,X的 轨道有3个电子。下列说法中不正确的是
轨道有3个电子。下列说法中不正确的是A.电负性: | B.简单离子半径: |
C.简单气态氢化物的稳定性: | D.M最高价氧化物对应水化物能与盐酸反应 |
您最近一年使用:0次
2023-02-14更新
|
1159次组卷
|
5卷引用:化学-2023年高考押题预测卷01(山东卷)(含考试版、全解全析、参考答案、答题卡)
(已下线)化学-2023年高考押题预测卷01(山东卷)(含考试版、全解全析、参考答案、答题卡)广东省茂名市2023届高三下学期一模考试化学试题(已下线)专题卷09 根据原子结构和物质结构特点叙述型元素推断-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题07 元素周期表和元素周期律广东省广州市第六十五中学2023-2024学年高三上学期8月摸底化学试题
名校
5 . 如图为一种饲料添加剂的结构。X、Y、Z三种元素占据相邻的两个周期,Z是宇宙中含量最多的元素,下列说法错误的是


| A.电负性:Y>X>Z |
| B.X、Y元素的简单气态氢化物沸点:Y>X |
| C.Y与Z形成的化合物都只含极性共价键 |
| D.X、Y、Z三种元素既可形成离子化合物,又可形成共价化合物 |
您最近一年使用:0次
2023-01-11更新
|
298次组卷
|
5卷引用:山东省日照市2022-2023学年高三上学期期末校际考试化学试题
山东省日照市2022-2023学年高三上学期期末校际考试化学试题山东省日照市2022-2023学年高三上学期期末校际联合考试化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(选择题1-5)福建省福州高级中学2023-2024学年高三第二次阶段考试化学试题
6 . 亚硫酰氯(SOCl2)在农药、医药、染料等生产中有重要应用,是一种无色或淡黄色液体,易挥发,遇水极易反应生成两种酸性气体。回答下列问题:
(1)根据价电子对互斥理论,亚硫酰氯空间构型为_______ ,其构成元素电负性由大到小的顺序为_______ 。
(2)实验室可通过将二氧化硫和氯气通入一氯化硫(S2Cl2)中反应制取亚硫酰氯。
①一氯化硫的电子式为_______ ;
②该反应中还原剂与氧化剂的物质的量之比为_______ ;
③向Ba(OH)2溶液中滴加少量亚硫酰氯,有白色沉淀生成,发生反应的离子方程式为_______ 。
(3)MgCl2·6H2O、AlCl3·6H2O、FeCl2·4H2O等结晶水合氯化物在空气中受热脱水易发生水解反应,常用亚硫酰氯作脱水剂以制取无水氯化物。
①在加热条件下,亚硫酰氯与MgCl2·6H2O反应的化学方程式为_______ 。
②MgCl2·6H2O在空气中受热脱水过程中,热重分析测得剩余固体质量占初始固体质量的百分含量随温度变化的曲线如图所示。
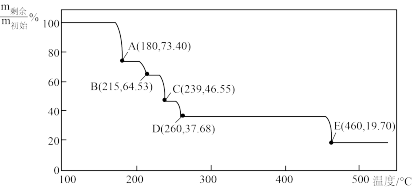
试判断A点固体的化学式为_______ ;460℃时发生反应的化学方程式为_______ 。
(1)根据价电子对互斥理论,亚硫酰氯空间构型为
(2)实验室可通过将二氧化硫和氯气通入一氯化硫(S2Cl2)中反应制取亚硫酰氯。
①一氯化硫的电子式为
②该反应中还原剂与氧化剂的物质的量之比为
③向Ba(OH)2溶液中滴加少量亚硫酰氯,有白色沉淀生成,发生反应的离子方程式为
(3)MgCl2·6H2O、AlCl3·6H2O、FeCl2·4H2O等结晶水合氯化物在空气中受热脱水易发生水解反应,常用亚硫酰氯作脱水剂以制取无水氯化物。
①在加热条件下,亚硫酰氯与MgCl2·6H2O反应的化学方程式为
②MgCl2·6H2O在空气中受热脱水过程中,热重分析测得剩余固体质量占初始固体质量的百分含量随温度变化的曲线如图所示。

试判断A点固体的化学式为
您最近一年使用:0次
2022-11-11更新
|
276次组卷
|
2卷引用:山东省青岛市四区县2022-2023学年高三上学期期中考试化学试题
名校
7 . 在29种生命必需的元素中,按体内含量的高低可分为常量元素(如:氧、碳、氢、氮、磷等)和微量元素(如:钒、锰、钴等),回答下列问题:
(1)胞嘧啶(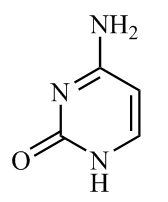 )是核酸(DNA和RNA)中的主要碱基组成成分之一。该分子中所有元素的电负性由小到大的顺序为
)是核酸(DNA和RNA)中的主要碱基组成成分之一。该分子中所有元素的电负性由小到大的顺序为_______ (填元素符号)。基态N原子核外电子的运动状态有_______ 种,1 mol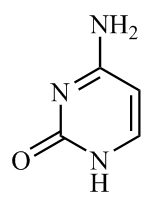 中含有
中含有 键的数目为
键的数目为_______ mol。
(2) 与
与 分子结构相似,键角
分子结构相似,键角
_______  (填“>”“<”或“=”),其原因为
(填“>”“<”或“=”),其原因为_______ 。
(3)锰在人体代谢、骨骼的形成和维生素C的合成过程中必不可少;钴是维生素B12组成部分;钒能降低血液中胆固醇的含量,还具有胰岛素的作用。基态Co原子核外电子排布式为_______ ,基态 价电子排布式为
价电子排布式为_______ , 的空间结构为
的空间结构为_______ 。
(1)胞嘧啶(
 )是核酸(DNA和RNA)中的主要碱基组成成分之一。该分子中所有元素的电负性由小到大的顺序为
)是核酸(DNA和RNA)中的主要碱基组成成分之一。该分子中所有元素的电负性由小到大的顺序为 中含有
中含有 键的数目为
键的数目为(2)
 与
与 分子结构相似,键角
分子结构相似,键角
 (填“>”“<”或“=”),其原因为
(填“>”“<”或“=”),其原因为(3)锰在人体代谢、骨骼的形成和维生素C的合成过程中必不可少;钴是维生素B12组成部分;钒能降低血液中胆固醇的含量,还具有胰岛素的作用。基态Co原子核外电子排布式为
 价电子排布式为
价电子排布式为 的空间结构为
的空间结构为
您最近一年使用:0次
2022-01-17更新
|
341次组卷
|
2卷引用:山东省济南市2021-2022上学期高二上学期期末考试化学试题
2021·福建福州·二模
名校
8 . 前四周期元素X、Y、Z、W、Q原子序数依次增大,其中Y、Z同周期,Z、W同主族;X、Y、Z是人体内含量最高的三种元素,X、Y、Z、W、Q五原子核外电子数之和为60。下列叙述合理的是
| A.原子半径X<Y<Z<W |
| B.电负性Q<X<Y<Z<W |
| C.这些元素组成的三元化合物都可溶于水 |
| D.它们基态原子最外层上都有未成对电子 |
您最近一年使用:0次
2021-04-27更新
|
743次组卷
|
5卷引用:押山东卷第03题 元素周期律、元素周期表-备战2021年高考化学临考题号押题(山东卷)
(已下线)押山东卷第03题 元素周期律、元素周期表-备战2021年高考化学临考题号押题(山东卷)福建省福州市2021届高中毕业班4月质量检测化学试题吉林省延边第二中学2020-2021学年高二下学期期中考试化学试题(已下线)第36讲 原子结构与性质(精练)-2022年一轮复习讲练测第一章原子结构与性质(提升卷)
解题方法
9 . W、X、Y、Z是原子序数依次增大的前四周期元素,W、Y在地壳中的含量处于前两位,X是周期表中电负性最大的元素,基态Z原子的价层电子数为8,下列说法正确的是
| A.最高化合价:X>W>Y |
| B.Y与W、Y与X形成的二元化合物晶体类型相同 |
| C.单质X在一定条件下能置换出单质W |
| D.Z与W两种元素形成的常见化合物均为黑色固体 |
您最近一年使用:0次
2013·山东枣庄·一模
解题方法
10 . 卤族元素是典型的非金属元素,包括F、Cl、Br、I等。请回答下面有关问题
(1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是_____ 。
(2)Br原子的M层核外电子排布式为_________ 。
(3)用价层电子对互斥理论判断BeCl2的构型为________ ,BF3分子中B-F键的键角为________ 。
(4)CCl4分子中碳原子的杂化方式为______ ,NF3分子的空间构型为_______ 。
(5)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中 Mg元素的质量分数为________ 。

(1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是
(2)Br原子的M层核外电子排布式为
(3)用价层电子对互斥理论判断BeCl2的构型为
(4)CCl4分子中碳原子的杂化方式为
(5)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中 Mg元素的质量分数为

您最近一年使用:0次



