名校
1 . 一水合甘氨酸锌是一种矿物类饲料添加剂,其结构简式如图所示。下列说法正确的是
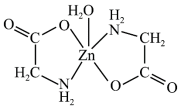
| A.基态Zn原子的核外电子有30种运动状态 |
| B.该结构中元素电负性大小比较:C<O<N |
| C.分子中C、N的杂化方式完全相同 |
D.该结构中Zn为中心原子,O、N为配位原子,与 的配合能力:N<O 的配合能力:N<O |
您最近一年使用:0次
名校
2 . 物质世界缤纷多彩,物质的性质与分子的结构紧密关联。回答下列问题:
I.非金属氟化物在生产、生活和科研中应用广泛。
(1)基态F原子核外电子的空间运动状态有____________ 种。
(2)O、F、Cl电负性由大到小的顺序为______________ ;OF2的熔、沸点___________ (填“高于”或“低于”)Cl2O,原因是__________ 。
Ⅱ、过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应。
(3)对于基态Cr原子,下列叙述正确的是_________ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d44s2
B.从空间角度看,4s轨道比3s轨道大,其空间包含了3s轨道
C.电负性比钾高,原子对键合电子的吸引力比钾大
(4)三价铬离子能形成多种配位化合物。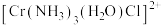 中提供孤电子对形成配位键的原子是
中提供孤电子对形成配位键的原子是___________ ,中心离子的配位数为___________ 。
(5)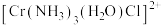 中配体分子NH3、H2O
中配体分子NH3、H2O
①键角:NH3___________ H2O(填“>”或“<”)。
②NH3极易溶于水,原因是____________ 。
(6)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是____________ 原子。设Cr和Al原子半径分别为 和
和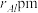 ,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为________ %(列出计算表达式)。
I.非金属氟化物在生产、生活和科研中应用广泛。
(1)基态F原子核外电子的空间运动状态有
(2)O、F、Cl电负性由大到小的顺序为
Ⅱ、过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应。
(3)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d44s2
B.从空间角度看,4s轨道比3s轨道大,其空间包含了3s轨道
C.电负性比钾高,原子对键合电子的吸引力比钾大
(4)三价铬离子能形成多种配位化合物。
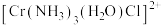 中提供孤电子对形成配位键的原子是
中提供孤电子对形成配位键的原子是(5)
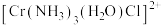 中配体分子NH3、H2O
中配体分子NH3、H2O①键角:NH3
②NH3极易溶于水,原因是
(6)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是
 和
和 ,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
您最近一年使用:0次
名校
3 . 物质结构决定物质性质。下列物质性质描述与结构解释错误的是
| 选项 | 物质性质 | 结构解释 |
| A | 稳定性:CH4>SiH4 | C-H键长更短,键能更大 |
| B | 沸点:对羟基苯甲醛( | 对羟基苯甲醛形成了分子间氢键,邻羟基苯甲醛形成了分子内氢键 |
| C | 酸性:CH3COOH>CH3CH2COOH | 烷基越长推电子效应越大,使羧基中羟基的极性越小,羧酸酸性越弱 |
| D | 键能:F-F键<Cl-Cl键 | F-F的键长短,原子核距离近,同种电荷排斥力强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 前四周期元素A、B、C、D、E的原子序数依次增大,A元素原子的核外电子只有一种运动状态;基态B原子s能级的电子总数比p能级的多1;基态C原子和基态E原子中成对电子数均是未成对电子数的3倍;D形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题:
(1)E的元素名称为___________ 。
(2)元素A、B、C中,电负性最大的是___________ (填元素符号 ) 。
(3)BC 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为___________ ,BC 的空间结构为
的空间结构为___________ 。
(4)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为a pm,则晶体的密度为___________ g·cm-3(用NA表示阿伏加德罗常数的值)。
(1)E的元素名称为
(2)元素A、B、C中,电负性最大的是
(3)BC
 中B原子轨道的杂化类型为
中B原子轨道的杂化类型为 的空间结构为
的空间结构为(4)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB的晶胞参数为a pm,则晶体的密度为
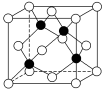
您最近一年使用:0次
名校
解题方法
5 . 依据原子结构知识回答下列问题。
(1)基态Cr原子的电子排布式是___________ 。
(2)下列有关微粒性质的排列顺序错误的是___________。
(3)下列硼原子电子排布图表示的状态中,能量最高的为___________(填选项字母)。
(4)O的基态原子核外电子空间运动状态有___________ 种,其原子半径___________  (填“大于”或“小于”)。
(填“大于”或“小于”)。
(1)基态Cr原子的电子排布式是
(2)下列有关微粒性质的排列顺序错误的是___________。
A.元素的电负性: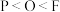 | B.元素的第一电离能: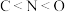 |
C.离子半径: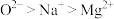 | D.原子的未成对电子数: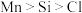 |
(3)下列硼原子电子排布图表示的状态中,能量最高的为___________(填选项字母)。
A. | B.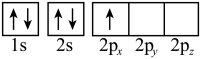 |
C.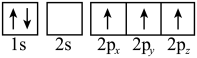 | D.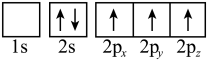 |
(4)O的基态原子核外电子空间运动状态有
 (填“大于”或“小于”)。
(填“大于”或“小于”)。
您最近一年使用:0次
名校
解题方法
6 . 氟元素可形成多种有工业价值和科研价值的化合物,如OF2、(CF)x、XeF2、HF、NH4BF4、CaF2等。
(1)基态F原子核外电子有______ 种空间运动状态,下列为氟原子激发态的电子排布式的是_____ (填序号)。
A.1s22s22p43s1 B.1s22s22p43d2 C.1s22s12p2 D.1s22s22p33p2
(2)F2通入稀NaOH溶液中可生成OF2,其中氧原子的杂化方式为_________ 。
(3)AlF3的熔点为1090℃,远高于AlCl3的熔点(192℃),其原因是___________ 。
(4)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物(CF)x,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,(CF)x的导电性________ (填“增强”或“减弱”),(CF)x中C-C键的键长比石墨中C-C键的_______ (填“长”或“短”)。

(5)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂HF、NH4BF4及清洗剂CH3CH(OH)CH3,三种物质中除H外的各元素的电负性由大到小的顺序为________ ,1mol氟硼酸铵(NH4BF4)中含有_______ mol配位键。
(1)基态F原子核外电子有
A.1s22s22p43s1 B.1s22s22p43d2 C.1s22s12p2 D.1s22s22p33p2
(2)F2通入稀NaOH溶液中可生成OF2,其中氧原子的杂化方式为
(3)AlF3的熔点为1090℃,远高于AlCl3的熔点(192℃),其原因是
(4)石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物(CF)x,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,(CF)x的导电性

(5)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂HF、NH4BF4及清洗剂CH3CH(OH)CH3,三种物质中除H外的各元素的电负性由大到小的顺序为
您最近一年使用:0次
名校
解题方法
7 . 钝、钒、铬、铁、镍、铜等过渡金属及其化合物在工业上有重要用途。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。 元素在元素周期表中的位置是
元素在元素周期表中的位置是_______ 。
(2)制备CrO2Cl2的反应为 。
。
①上述化学方程式中非金属元素电负性由小到大的顺序为_______ (用元素符号表示)。
②COCl2分子中所有原子均满足8电子稳定结构,COCl2分子中π键和σ键的个数比为_______ ,中心原子的杂化方式为_______ 。
(3)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:_______ 。
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是_______ 。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
 元素在元素周期表中的位置是
元素在元素周期表中的位置是(2)制备CrO2Cl2的反应为
 。
。①上述化学方程式中非金属元素电负性由小到大的顺序为
②COCl2分子中所有原子均满足8电子稳定结构,COCl2分子中π键和σ键的个数比为
(3)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:
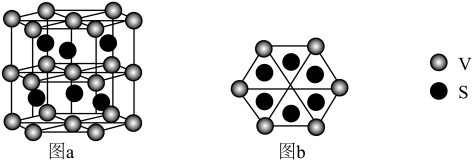
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是
您最近一年使用:0次
8 . 下列事实的解释错误的是
| 事实 | 解释 | |
| A | 酸性:CH3COOH<CCl3COOH<CF3COOH | H的电负性小于氯原子,氯原子小于氟原子,电负性越强羟基上的氢原子越容易电离,酸性越强 |
| B | 第一电离能: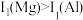 | Mg为3p轨道全空的稳定电子构型,而Al失去一个电子变为3p轨道全空的稳定电子构型 |
| C | O2与O3分子极性相同 | 二者都是由非极性键构成的分子 |
| D |
| 前者形成了分子内氢键,后者形成分子间氢键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . A、B、C、D为原子序数依次增大的四种短周期主族元素,A2−和B+具有相同的电子构型;C、D为同周期元素,C的核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是___________ (填元素符号),其中C原子的价电子排布图为___________ 。
(2)与元素A同族的简单氢化物中,稳定性最强的是___________ (填分子式),请从原子结构和键参数的角度解释原因___________ ;A与B形成化合物B2A2的电子式为___________ 。
(3)C和D反应可生成组成比为1∶3的化合物E,E的空间结构为___________ ,中心原子的杂化轨道类型为___________ 。
(4)基态D原子的核外电子有___________ 种空间运动状态;基态D原子核外占据最高能层电子的电子云轮廓图的形状为___________ 。
(1)四种元素中电负性最大的是
(2)与元素A同族的简单氢化物中,稳定性最强的是
(3)C和D反应可生成组成比为1∶3的化合物E,E的空间结构为
(4)基态D原子的核外电子有
您最近一年使用:0次
10 . 前四周期主族元素X、Y、Z、Q的原子序数依次增大,基态X原子核外电子占据两种形状不同的原子轨道,且两种轨道中电子总数相等,Q与X处于同一主族。Y的周期序数与族序数相等,Z的第二电离能远小于第三电离能。下列说法正确的是
A.电负性: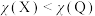 | B.最高价氧化物对应水化物的碱性:Y<Z |
| C.Z的氯化物是工业漂白粉的有效成分 | D.X形成的氢化物中只有极性共价键 |
您最近一年使用:0次
2023-10-17更新
|
296次组卷
|
4卷引用:重庆市铜梁一中等重点中学2023-2024学年高二下学期3月月考化学试题

 )<邻羟基苯甲醛(
)<邻羟基苯甲醛( )
)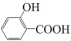 的沸点比
的沸点比 低
低

