2018·四川攀枝花·二模
名校
1 . 含氮、磷化合物在生活和生产中有许多重要用途,如:(CH3)3N、磷化硼(BP)、磷青铜(Cu3SnP)等。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_________ ,据此推测,锡的最高正价是_________ 。
(2)与P同周期的主族元素中,电负性比P小的元素有____ 种 ,第一电离能比P大有____ 种。
(3)PH3分子的空间构型为___________ 。PH3的键角小于NH3的原因是__________ 。
(4)化合物(CH3)3N能溶于水,试解析其原因____________ 。
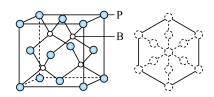
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为________ ,磷原子的配位数为________ 。
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为______ g/cm3。
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑________ 。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为
(2)与P同周期的主族元素中,电负性比P小的元素有
(3)PH3分子的空间构型为
(4)化合物(CH3)3N能溶于水,试解析其原因

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑
您最近一年使用:0次
2019-02-13更新
|
2515次组卷
|
8卷引用:2020年海南卷化学高考真题变式题15-19
(已下线)2020年海南卷化学高考真题变式题15-19【市级联考】四川省攀枝花市2019届高三上学期第二次统考化学试题【市级联考】山东省泰安市2019届高三下学期二轮模拟考试理科综合化学试题江西省上饶市2020届第一次高考模拟考试理科综合化学试题解题达人.化学选择题(2021全国卷)精编特训06(已下线)2021年高考全国甲卷化学试题变式题2020年全国卷Ⅰ理综化学高考真题变式题河南省驻马店市新蔡县第一高级中学2021-2022学年高二下学期7月份月考化学试题
2 . 第ⅣA族元素及其化合物在生产、生活中应用广泛。回答下列问题:
(1)基态锗原子的价层电子轨道表示式为______ ,第ⅣA族元素位于______ 区。
(2) 的电负性比
的电负性比 大,其主要原因是
大,其主要原因是_________________ 。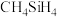 、
、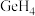 的稳定性依次减弱,其主要原因是
的稳定性依次减弱,其主要原因是______________________ 。
(3) 的VSEPR模型名称为
的VSEPR模型名称为________________________________ 。
(4)碳化硅( )熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为
)熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为______ 。
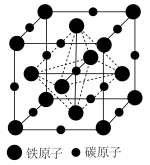
(5)铁和碳能形成如图所示的晶胞。它可以看成是铁晶胞中插入若干个碳原子,晶胞体积不变。铁碳晶体的化学式为______ ,铁晶体转化为铁碳晶体时晶体密度净增______ %(结果保留3位有效数字)。
(1)基态锗原子的价层电子轨道表示式为
(2)
 的电负性比
的电负性比 大,其主要原因是
大,其主要原因是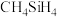 、
、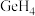 的稳定性依次减弱,其主要原因是
的稳定性依次减弱,其主要原因是(3)
 的VSEPR模型名称为
的VSEPR模型名称为(4)碳化硅(
 )熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为
)熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为(5)铁和碳能形成如图所示的晶胞。它可以看成是铁晶胞中插入若干个碳原子,晶胞体积不变。铁碳晶体的化学式为
您最近一年使用:0次
名校
3 . 回答下列问题:
(1)金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。铝原子核外有_______ 种不同空间运动状态的电子,其最高能级的电子云形状为_______ 。
(2)过渡金属元素铬 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。
回答下列问题:
①对于基态 原子,下列叙述正确的是
原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B. 电子能量较高,总是在比
电子能量较高,总是在比 电子离核更远的地方运动
电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
② 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。

 中P的杂化类型是
中P的杂化类型是_______ , 的键角小于
的键角小于 的,分析原因:
的,分析原因:_______ 。
(1)金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。铝原子核外有
(2)过渡金属元素铬
 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
①对于基态
 原子,下列叙述正确的是
原子,下列叙述正确的是A.轨道处于半充满时体系总能量低,核外电子排布应为

B.
 电子能量较高,总是在比
电子能量较高,总是在比 电子离核更远的地方运动
电子离核更远的地方运动C.电负性比钾高,原子对键合电子的吸引力比钾大
②
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。
 中P的杂化类型是
中P的杂化类型是 的键角小于
的键角小于 的,分析原因:
的,分析原因:
您最近一年使用:0次
名校
解题方法
4 . 研究表明新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”。回答下列问题:
(1)铜的晶胞结构如下图所示,铜原子的配位数为_______ ,基态铜原子价层电子排布式为_______ 。

(2)如果A原子的坐标为(0,1,0),则B原子的坐标为_______ ;
(3)与铜同周期,N能层电子数与铜相同,熔点最低的金属是_______ 。
(4)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),碱式硫酸铜中非金属元素电负性由大到小的顺序是_______ , 的空间构型为
的空间构型为_______ 。
(1)铜的晶胞结构如下图所示,铜原子的配位数为

(2)如果A原子的坐标为(0,1,0),则B原子的坐标为
(3)与铜同周期,N能层电子数与铜相同,熔点最低的金属是
(4)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),碱式硫酸铜中非金属元素电负性由大到小的顺序是
 的空间构型为
的空间构型为
您最近一年使用:0次
名校
解题方法
5 . C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外最外层电子排布式______ ,C、O、Si三种元素的电负性由大到小的顺序为______ 。
(2)干冰是分子晶体,其密度比冰大的原因是____________ 。
(3)氧化物XO的电子总数与SiC的相等,则X为______ (填元素符号),XO是优良的耐高温材料,其熔点比CaO高的原因是__________________ 。
(4)在30 g 晶体中含
晶体中含______ mol Si-O键。
(1)写出Si的基态原子核外最外层电子排布式
(2)干冰是分子晶体,其密度比冰大的原因是
(3)氧化物XO的电子总数与SiC的相等,则X为
(4)在30 g
 晶体中含
晶体中含
您最近一年使用:0次
名校
解题方法
6 . 按要求填空。
(1)一个基态原子电子排布为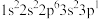 的元素最可能的价态是
的元素最可能的价态是___________ ;某元素原子的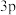 原子轨道中有3个未成对电子,则该原子的
原子轨道中有3个未成对电子,则该原子的价电子轨道表示式 为___________ 。
(2)第四周期中,未成对电子数目最多的元素是___________ ;价层电子排布式为 的基态原子的原子结构示意图
的基态原子的原子结构示意图___________ 。
(3)元素周期表中能稳定存在且电负性相差最大的两种元素形成的化合物的化学式为_______ 。
(4) 三种短周期元素的原子序数
三种短周期元素的原子序数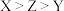 ,X和Z原子核外s电子与p电子数之比都为
,X和Z原子核外s电子与p电子数之比都为 ,Y原子最外层s电子与p电子数之比为
,Y原子最外层s电子与p电子数之比为 ,
,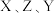 三者所形成的常见化合物的化学式为
三者所形成的常见化合物的化学式为_____ 。
(1)一个基态原子电子排布为
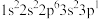 的元素最可能的价态是
的元素最可能的价态是 原子轨道中有3个未成对电子,则该原子的
原子轨道中有3个未成对电子,则该原子的(2)第四周期中,未成对电子数目最多的元素是
 的基态原子的原子结构示意图
的基态原子的原子结构示意图(3)元素周期表中能稳定存在且电负性相差最大的两种元素形成的化合物的化学式为
(4)
 三种短周期元素的原子序数
三种短周期元素的原子序数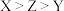 ,X和Z原子核外s电子与p电子数之比都为
,X和Z原子核外s电子与p电子数之比都为 ,Y原子最外层s电子与p电子数之比为
,Y原子最外层s电子与p电子数之比为 ,
,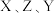 三者所形成的常见化合物的化学式为
三者所形成的常见化合物的化学式为
您最近一年使用:0次
名校
7 . 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示.

(1)S2Cl2的结构式为_____ ,其化学键类型有_____ (填“极性键”“非极性键”或“极性键和非极性键”).
(2)电负性:S_____ (填“>”或“<”)Cl,S2Cl2中硫的化合价为_____ .
(3)S2Cl2分子中S原子的杂化轨道类型为_____ ,每个S原子有_____ 对孤电子对.

(1)S2Cl2的结构式为
(2)电负性:S
(3)S2Cl2分子中S原子的杂化轨道类型为
您最近一年使用:0次
2016-12-09更新
|
625次组卷
|
6卷引用:海南省三亚华侨学校(南新校区)2020-2021学年高二下学期期中考试化学试题
解题方法
8 . N、O、S、Cl、Cu五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
(1)第一电离能:N_____ O(填“ ”或“
”或“ ”,下同),电负性:S
”,下同),电负性:S____ Cl。
(2) 的沸点比
的沸点比 高的原因是
高的原因是___________ ; 属于
属于________ (填“极性”或“非极性”)分子,
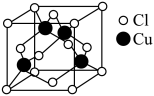
(3)Cu与Cl形成化合物的晶胞如图所示。该晶体的化学式为________ 。
(1)第一电离能:N
 ”或“
”或“ ”,下同),电负性:S
”,下同),电负性:S(2)
 的沸点比
的沸点比 高的原因是
高的原因是 属于
属于(3)Cu与Cl形成化合物的晶胞如图所示。该晶体的化学式为

您最近一年使用:0次
解题方法
9 . 第VA族元素在化学领域具有重要的地位。请回答下列问题:N是第VA族原子半径最小的元素,基态氮原子的价电子轨道表示式为_______ ;NH3分子的空间结构名称为_______ ,中心原子的杂化轨道类型为_______ ;C、N、O三种元素第一电离能由大到小的顺序是_______ 。P和N电负性大小比较_______ 。
您最近一年使用:0次
10 . (1)元素C、N、O、K的电负性从大到小依次为______ 。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为______ 。
(3)下图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是______ (填“A”“B”“C”或“D”)。

(4)氮化硼(BN)是一种重要的功能陶瓷材料。基态B原子的电子排布式为______ ;B和N相比,电负性较大的是______ ,BN中B元素的化合价为______ 。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
(3)下图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是

(4)氮化硼(BN)是一种重要的功能陶瓷材料。基态B原子的电子排布式为
您最近一年使用:0次
2019-07-07更新
|
183次组卷
|
3卷引用:海南省三亚华侨学校(南新校区)2020-2021学年高二下学期3月月考化学试jgh同



