23-24高三上·浙江杭州·期中
1 . 铝是常见金属,其合金、化合物在生产生活中有重要应用。请回答:
(1)能量最低的激发态 的核外电子排布式是
的核外电子排布式是___________ 。
(2)铝能与H、C、N、F、Cl 等元素形成多种化合物
①下列说法不正确 的是___________ 。
A. 中Al原子的杂化方式是sp2
中Al原子的杂化方式是sp2
B.化学键中离子键成分的百分数: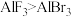
C. 分子中有6对共用电子对
分子中有6对共用电子对
D. 中所有原子或离子满足8 电子稳定结构
中所有原子或离子满足8 电子稳定结构
②常温下 AlCl3在四氯化碳中的溶解度大于MgCl2,理由是___________ 。
③三乙基铝是一种金属有机物,结构简式为Al(C2H5)3,可做高能火箭燃料,原因是___________ 。
(3)AlP 晶胞结构如下图所示:
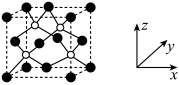
①磷化铝晶胞沿着 y轴的投影图为_________ (填选项字母)。
A. B.
B.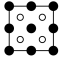 C.
C.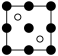 D.
D.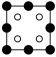
②若磷化铝的晶胞边长为 apm,NA表示阿伏加德罗常数的值,则 AlP晶体的密度为_________ g∙cm−3(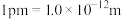 用含 NA、a 的最简代数式表示)。
用含 NA、a 的最简代数式表示)。
(1)能量最低的激发态
 的核外电子排布式是
的核外电子排布式是(2)铝能与H、C、N、F、Cl 等元素形成多种化合物
①下列说法
A.
 中Al原子的杂化方式是sp2
中Al原子的杂化方式是sp2B.化学键中离子键成分的百分数:
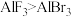
C.
 分子中有6对共用电子对
分子中有6对共用电子对D.
 中所有原子或离子满足8 电子稳定结构
中所有原子或离子满足8 电子稳定结构②常温下 AlCl3在四氯化碳中的溶解度大于MgCl2,理由是
③三乙基铝是一种金属有机物,结构简式为Al(C2H5)3,可做高能火箭燃料,原因是
(3)AlP 晶胞结构如下图所示:

①磷化铝晶胞沿着 y轴的投影图为
A.
 B.
B. C.
C. D.
D.
②若磷化铝的晶胞边长为 apm,NA表示阿伏加德罗常数的值,则 AlP晶体的密度为
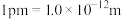 用含 NA、a 的最简代数式表示)。
用含 NA、a 的最简代数式表示)。
您最近一年使用:0次
19-20高二上·宁夏石嘴山·期末
2 . 按要求作答
(1)钴位于元素周期表的第__ 族,其基态原子中未成对电子个数为__ 。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为__ ,所含非金属元素的电负性由大到小的顺序是__ 。
(3)尿素[CO(NH2)2]分子中σ键与π键的数目之比为__ 。
(4)硒、硅均能与氢气化合形成气态氢化物,若“Si-H”中共用电子对偏向氢,氢气与硒反应时,硒单质做氧化剂,则硒与硅的电负性大小为Se__ Si(填“>”或“<”)
(5)与Si同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表__ 。
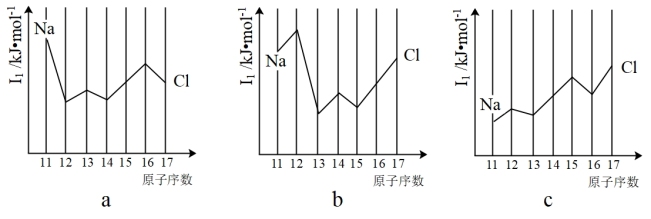
A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2
(1)钴位于元素周期表的第
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为
(3)尿素[CO(NH2)2]分子中σ键与π键的数目之比为
(4)硒、硅均能与氢气化合形成气态氢化物,若“Si-H”中共用电子对偏向氢,氢气与硒反应时,硒单质做氧化剂,则硒与硅的电负性大小为Se
(5)与Si同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表

A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2
您最近一年使用:0次
2020-01-10更新
|
873次组卷
|
4卷引用:化学预测卷(八)-预测卷(浙江专版)
11-12高三·浙江台州·阶段练习
解题方法
3 . 决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
A通常显___________ 价,A的电负性___________ B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长λ与光的频率v的关系为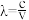 ,其中光速c=3×108m·s-1.根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量
,其中光速c=3×108m·s-1.根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量___________ kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:___________ 。
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是___________ 。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有___________ 个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是___________ 。
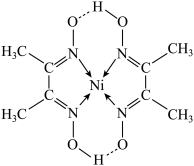
(5)某配合物的分子结构如图所示,其分子内不含有___________ (填字母)。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
A通常显
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长λ与光的频率v的关系为
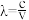 ,其中光速c=3×108m·s-1.根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量
,其中光速c=3×108m·s-1.根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量| 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是
(5)某配合物的分子结构如图所示,其分子内不含有___________ (填字母)。

| A.离子键 | B.共价键 | C.配位键 | D.氢键 |
您最近一年使用:0次



