名校
1 . 用化学知识解答问题:
(1)铜器在潮湿的空气中,表面会慢慢地生成一层铜锈(碱式碳酸铜),该反应的化学方程式为___________ 。
(2)在日常生活中常用一些铝制器皿,在清洗铝制器皿表面的污垢时,不能使用热的碱性溶液的原因时(用化学方程式解释)___________ 。
(3)发射卫星的火箭用联氨( )作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为
)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为___________ 。
(4)比较甲酸、乙酸、丙酸的酸性大小,并解释原因___________
(5)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
比较两元素的 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,对此你的解释是
再失去1个电子难,对此你的解释是___________ 。
(1)铜器在潮湿的空气中,表面会慢慢地生成一层铜锈(碱式碳酸铜),该反应的化学方程式为
(2)在日常生活中常用一些铝制器皿,在清洗铝制器皿表面的污垢时,不能使用热的碱性溶液的原因时(用化学方程式解释)
(3)发射卫星的火箭用联氨(
 )作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为
)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为(4)比较甲酸、乙酸、丙酸的酸性大小,并解释原因
(5)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
| 元素 | Mn | Fe | |
电离能/ |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,对此你的解释是
再失去1个电子难,对此你的解释是
您最近一年使用:0次
2023-08-19更新
|
126次组卷
|
2卷引用:河北省昌黎第一中学2023届高三下学期第五次调研考试化学试题
2 . 硅、硼、铜、硒的单质及化合物在现代工业生产中有着广泛应用。回答下列问题:
(1)基态Cu+的核外价层电子排布式为_______________ ;Be、B、Al的第一电离能由大到小的顺序是______________________________ 。
(2)硒、硅均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se___ Si(填“>”、“<”)。
(3)SeO32-中Se原子的杂化类型为______ ,与其互为等电子体的一种分子的分子式是______________ 。
(4)CuSO4和Cu(NO3)2是自然界中重要的铜盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为_________ ,Cu(NO3)2中的化学键除了σ键外,还存在_______________ 。
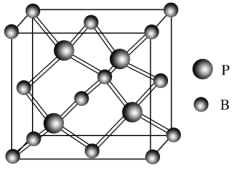
(5)磷化硼(BP)是一种耐磨材料,熔点高,其晶胞结构如图所示。该晶胞中B的堆积方式为___________ ,已知该晶体的晶胞参数a pm,用NA代表阿伏伽德罗常数的值,则该晶体的密度为____ g·cm-3;构成晶体的两种粒子之间的最近距离为__________ pm。
(1)基态Cu+的核外价层电子排布式为
(2)硒、硅均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se
(3)SeO32-中Se原子的杂化类型为
(4)CuSO4和Cu(NO3)2是自然界中重要的铜盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为
(5)磷化硼(BP)是一种耐磨材料,熔点高,其晶胞结构如图所示。该晶胞中B的堆积方式为

您最近一年使用:0次
名校
解题方法
3 . 新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____ ,该能层具有的原子轨道数为_____ .
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____ ,B原子的杂化轨道类型是_____ .
Li、B、H元素的电负性由大到小排列顺序为_____ .
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____ H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是_____ (填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____ ,NaH的理论密度是___________ g•cm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是
Li、B、H元素的电负性由大到小排列顺序为
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+
| I1/kJ•mol﹣1 | I2/kJ•mol﹣1 | I3/kJ•mol﹣1 | I4/kJ•mol﹣1 | I5/kJ•mol﹣1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
M是
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为
您最近一年使用:0次
2013·河北邯郸·二模
4 . 冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为2Al(OH)3+12HF+3A =2Na3AlFs+3CO2+9H2O。
(1)熔融晶体A时痛要破坏的作用力是_______ ,冰晶石中的配位体是______ 。
(2)上述反应的生成物中属于非极性分子的中心原子的杂化轨道类型为________________ ,该分子的空间构型为___________ 。
(3)上述反应的反应物中有两种元素在元素周期表中的位置相邻,用化学方程式表示二者的电负性大小:____________ ;写出含有其中电负性较小元素的原子,且形成的分子的空间构型呈“V”形的物质的化学式(单质和化合物各写一种)_______________ 、________________ 。
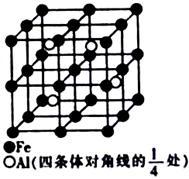
(4)某种Al—Fe合金的晶胞如图所示,该合金的化学式为_________ 。若晶胞的边长为a nm,则合金的密度为______ g• cm-3。
(1)熔融晶体A时痛要破坏的作用力是
(2)上述反应的生成物中属于非极性分子的中心原子的杂化轨道类型为
(3)上述反应的反应物中有两种元素在元素周期表中的位置相邻,用化学方程式表示二者的电负性大小:
(4)某种Al—Fe合金的晶胞如图所示,该合金的化学式为

您最近一年使用:0次



