1 . 铁和铜都是生产、生活中应用广泛的金属,能形成很多种合金和化合物。请回答下列问题:
(1)基态 的价层电子排布图为
的价层电子排布图为___________ 。基态 中有
中有___________ 种运动状态不同的电子。
(2)铁单质能形成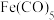 ,其熔点为-21℃,沸点为102.8℃。则
,其熔点为-21℃,沸点为102.8℃。则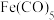 晶体的类型为
晶体的类型为___________ 。与CO互为等电子体的离子的符号为___________ (任写一种)。
(3)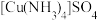 中,N、S、O三种非金属元素的第一电离能由小到大的顺序为
中,N、S、O三种非金属元素的第一电离能由小到大的顺序为___________ ,阴离子的空间构型为___________ ,其中心原子的杂化轨道类型为___________ 。
(4)铁单质的一种晶体的堆积模型为体心立方堆积,晶胞参数为a pm;铜单质的一种晶体的堆积模型为面心立方最密堆积,晶胞参数为b pm。则两种晶体中,铁原子和铜原子的配位数之比为___________ 。
(1)基态
 的价层电子排布图为
的价层电子排布图为 中有
中有(2)铁单质能形成
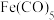 ,其熔点为-21℃,沸点为102.8℃。则
,其熔点为-21℃,沸点为102.8℃。则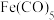 晶体的类型为
晶体的类型为(3)
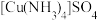 中,N、S、O三种非金属元素的第一电离能由小到大的顺序为
中,N、S、O三种非金属元素的第一电离能由小到大的顺序为(4)铁单质的一种晶体的堆积模型为体心立方堆积,晶胞参数为a pm;铜单质的一种晶体的堆积模型为面心立方最密堆积,晶胞参数为b pm。则两种晶体中,铁原子和铜原子的配位数之比为
您最近一年使用:0次
名校
2 . 钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。回答下列问题:
(1)基态Ti原子的核外电子排布式为___________ 。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是___________ 。
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是___________ ;金属离子与氧离子间的作用力为___________ ,Ca2+的配位数是___________ 。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH ,其晶胞如图(b)所示,其中Pb2+与图(a)中
,其晶胞如图(b)所示,其中Pb2+与图(a)中___________ 的空间位置相同。有机碱CH3NH 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是___________ 。若晶胞参数为a nm,则晶体密度为___________ g·cm-3(列出计算式)。
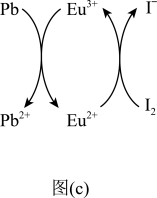
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该过程的总反应:___________ ,Eu3+在反应中的功能___________ 。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH
 ,其晶胞如图(b)所示,其中Pb2+与图(a)中
,其晶胞如图(b)所示,其中Pb2+与图(a)中 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该过程的总反应:

您最近一年使用:0次
名校
解题方法
3 . 金属钛有“生物金属、海洋金属、太空金属”的美称。有些含钛的化合物在耐高温、环保或者抑菌方面有着重要的应用,钛元素也被称为“健康钛”。
(1)Ti元素位于元素周期表的_______ 区,基态原子电子排布式为_______ 。
(2)TiCl4与SiCl4互为等电子体。SiCl4可以与N-甲基咪唑
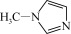
 发生反应。
发生反应。
①TiCl4分子的空间构型为_______ 。
②N-甲基咪唑分子中碳原子的杂化轨道类型为_______ ,C、N、Si的电负性由大到小的顺序为_______ ,1个 含有
含有_______ 个π键。
(3)TiCl4可以与胺形成配合物,如TiCl4(CH3NH2)2、TiCl4(H2NCH2CH2NH2)。
① TiCl4 (H2NCH2CH2NH2)中提供电子对形成配位键的原子是_______ 。
②乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性较差的是_______ (填“Mg2+”或“Cu2+”)。
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似(如图),其中阴离子(N3-)采用面心立方最密堆积方式,X-射线衍射实验测得氮化钛的晶胞参数(晶胞边长)为a pm,则r(N3-)为_______ pm。该氮化钛的密度为_______ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。

(1)Ti元素位于元素周期表的
(2)TiCl4与SiCl4互为等电子体。SiCl4可以与N-甲基咪唑


 发生反应。
发生反应。①TiCl4分子的空间构型为
②N-甲基咪唑分子中碳原子的杂化轨道类型为
 含有
含有(3)TiCl4可以与胺形成配合物,如TiCl4(CH3NH2)2、TiCl4(H2NCH2CH2NH2)。
① TiCl4 (H2NCH2CH2NH2)中提供电子对形成配位键的原子是
②乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性较差的是
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似(如图),其中阴离子(N3-)采用面心立方最密堆积方式,X-射线衍射实验测得氮化钛的晶胞参数(晶胞边长)为a pm,则r(N3-)为

您最近一年使用:0次
2021-11-18更新
|
909次组卷
|
7卷引用:黑龙江省大庆市2022届高三上学期第一次教学质量检测化学试题
黑龙江省大庆市2022届高三上学期第一次教学质量检测化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】17山东省威海乳山市银滩高级中学2021-2022学年高二12月月考化学试题黑龙江省大庆市2023-2024学年高三上学期第一次模拟考试化学试题(已下线)一轮巩固卷8-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)宁夏吴忠市2022届高三4月模拟联考(二模)理科综合化学试题江西省重点校2022-2023学年高三上学期第二次联考化学试题.
4 . 碳族元素的单质及其化合物在生产、生活中是一类重要物质。请回答下列问题:
(1)硅原子核外有___________ 种不同运动状态的电子,第一电离能介于铝和硅之间的元素的名称为___________ 。
(2)青蒿素(C15H22O5)的结构如图所示,图中数字标识的五个碳原子的杂化轨道类型为sp2的是___________ (填碳原子的标号),组成青蒿素的三种元素的电负性由大到小排序是___________ 。

(3)青蒿素分子中,从电子云重叠方式分析氧元素形成的共价键类型有___________
(4)SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3,Na2SnO3中阴离子空间构型为___________ 。
(1)硅原子核外有
(2)青蒿素(C15H22O5)的结构如图所示,图中数字标识的五个碳原子的杂化轨道类型为sp2的是

(3)青蒿素分子中,从电子云重叠方式分析氧元素形成的共价键类型有
(4)SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3,Na2SnO3中阴离子空间构型为
您最近一年使用:0次
解题方法
5 . 翡翠是一类名贵的装饰品,其主要成分为硅酸铝钠(NaAlSi2O6),常含微量Cr、Ni、Mn等元素。回答下列问题:
(1)基态硅原子的电子排布式为___________ ;基态铬原子的价电子排布图不能写成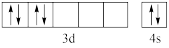 形式,其原因是违背了
形式,其原因是违背了___________ 。
(2)NaAlSi2O6中四种元素第一电离能由大到小的顺序为___________ (填元素符号),灼烧硅酸铝钠时,当钠元素的价电子由___________ (填“激发态”或“基态”)跃迁到另一状态时产生黄色火焰。
(3)双聚氯化铝(Al2Cl6)中只存在氯铝键,物质中各原子均达到8电子稳定结构,Al2Cl6的结构式为___________ (若有配位键,用→标出)。硅与碳类似,能与氢元素形成SiH4、Si2H4、Si3H8,此三种分子中硅原子的杂化轨道类型有___________ ;分子空间构型属于正四面体的是___________ 。
(4)已知单质钠、铝的熔点分别为98℃、660℃,从结构的角度解释导致这种差异的主要原因:___________ 。
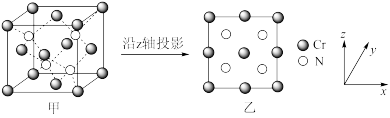
(5)某N、Cr元素组成的化合物具有高的硬度和良好的耐磨性,是一种很受重视的耐磨涂层,其晶胞结构如图甲,图乙为晶胞沿z轴投影图,该化合物的化学式为___________ 。知该晶体密度为ρ g·cm-3.晶体中Cr原子和N的最近核间距为___________ pm(NA表示阿伏加德罗常数值)。
(1)基态硅原子的电子排布式为
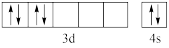 形式,其原因是违背了
形式,其原因是违背了(2)NaAlSi2O6中四种元素第一电离能由大到小的顺序为
(3)双聚氯化铝(Al2Cl6)中只存在氯铝键,物质中各原子均达到8电子稳定结构,Al2Cl6的结构式为
(4)已知单质钠、铝的熔点分别为98℃、660℃,从结构的角度解释导致这种差异的主要原因:
(5)某N、Cr元素组成的化合物具有高的硬度和良好的耐磨性,是一种很受重视的耐磨涂层,其晶胞结构如图甲,图乙为晶胞沿z轴投影图,该化合物的化学式为

您最近一年使用:0次
名校
6 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为___________  填标号
填标号 。
。
A. B.
B.
C. D.
D.
(2)基态 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为___________ 。
(3)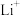 与
与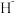 具有相同的电子构型,
具有相同的电子构型, 小于
小于 ,原因是
,原因是___________ 。
(4)与铁同周期元素中,4s轨道半充满的元素___________ (用元素符号表示)。
(5) 是离子化合物,其形成过程如下,已知第一电离能为气态基态原子失去一个电子成为气态基态阳离子所需的能量,则Li原子的第一电离能为
是离子化合物,其形成过程如下,已知第一电离能为气态基态原子失去一个电子成为气态基态阳离子所需的能量,则Li原子的第一电离能为___________  键键能为
键键能为___________  。
。

(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
 填标号
填标号 。
。A.
 B.
B.
C.
 D.
D.
(2)基态
 与
与 离子中未成对的电子数之比为
离子中未成对的电子数之比为(3)
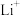 与
与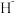 具有相同的电子构型,
具有相同的电子构型, 小于
小于 ,原因是
,原因是(4)与铁同周期元素中,4s轨道半充满的元素
(5)
 是离子化合物,其形成过程如下,已知第一电离能为气态基态原子失去一个电子成为气态基态阳离子所需的能量,则Li原子的第一电离能为
是离子化合物,其形成过程如下,已知第一电离能为气态基态原子失去一个电子成为气态基态阳离子所需的能量,则Li原子的第一电离能为 键键能为
键键能为 。
。
您最近一年使用:0次
名校
7 . 下列叙述正确的是
A. 与 与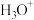 均为10电子粒子,它们互为等电子体 均为10电子粒子,它们互为等电子体 |
| B.Na、Mg、Al的第一电离能逐渐增大 |
C.基态碳原子的电子排布图为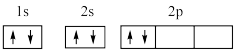 |
| D.N、O、F的电负性逐渐增大 |
您最近一年使用:0次
2021-04-22更新
|
205次组卷
|
2卷引用:黑龙江省大庆中学2020—2021学年高二下学期第一次月考化学试题
解题方法
8 . x、 y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知
| A.x的原子半径大于y的原子半径 | B.x的电负性大于y的电负性 |
| C.x的非金属性小于y的非金属性 | D.x的第一电离能小于y的第一电离能 |
您最近一年使用:0次
名校
解题方法
9 . 2019 年,我国青年化学家雷晓光被遴选为“青年化学家元素周期表”氮元素的代言人。下列与氮元素有关的说法正确的是
| A.14N与14C互为同位素 | B.NH3的热稳定性比HF的强 |
| C.34gNH3的电子数为20NA | D.Si3N4中N为+3价 |
您最近一年使用:0次
2020-12-21更新
|
240次组卷
|
3卷引用:黑龙江省哈尔滨第六中学2020-2021学年高二下学期期中考试化学试题
黑龙江省哈尔滨第六中学2020-2021学年高二下学期期中考试化学试题黑龙江省实验中学2021届高三上学期12月月考化学试题(已下线)练习18 原子结构与元素的性质-2020-2021学年【补习教材·寒假作业】高二化学(人教版)
名校
解题方法
10 . C、Si在元素周期表中属于同主族元素,其常见的氧化物分别为CO2、SiO2。请回答下列问题:
(1)锗与碳、硅同主族,写出锗原子基态时的核外电子排布式:____________ 。
(2)C、O、Si三种元素的电负性由大到小的顺序为____________ (用元素符号表示)。
(3)二氧化硅结构跟硅晶体结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察下图中硅晶体的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目为____________ ;晶体硅中硅原子与共价键的数目比为____________ 。
(4)下图是二氧化碳的晶胞模型,从晶体类型来看,CO2属于_______ 晶体。图中显示出的二氧化碳分子数有________ 个,实际上一个二氧化碳晶胞中含有_______ 个二氧化碳分子。标准状况下2.24 L的CO2分子中含有的π键的数目为______ 。
(5)在二氧化碳晶胞中,最近的两个二氧化碳分子间的距离为a nm,NA为阿伏加 德罗常数的值,则晶体密度为____________ g·cm-3。
(1)锗与碳、硅同主族,写出锗原子基态时的核外电子排布式:
(2)C、O、Si三种元素的电负性由大到小的顺序为
(3)二氧化硅结构跟硅晶体结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察下图中硅晶体的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目为
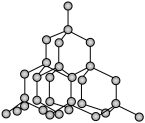
(4)下图是二氧化碳的晶胞模型,从晶体类型来看,CO2属于
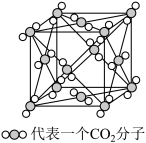
(5)在二氧化碳晶胞中,最近的两个二氧化碳分子间的距离为a nm,NA为阿伏加 德罗常数的值,则晶体密度为
您最近一年使用:0次
2020-09-22更新
|
345次组卷
|
3卷引用:黑龙江省青冈县第一中学校2022届高三上学期第一次模拟考试化学试题



