名校
解题方法
1 . a、b、c、d、e、f分别是H、C、N、Na、Si、Cu六种元素中的其中一种,已知:下图甲表示的是这六种元素单质的熔点高低顺序,其中c、d均是热和电的良导体,f形成的某种单质硬度最大。
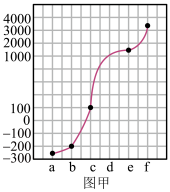
回答下列问题:
(1)a、b、f三种元素的电负性从小到大的顺序为___________ (用元素符号表示);
(2)元素b的单质的一个分子中含有___________ 个σ键和___________ 个π键;
(3)c单质分别与氟气和氯气形成化合物甲和乙,则甲的熔点___________ 乙的熔点(填>或<);
(4)元素d的基态原子的价电子排布式为___________ ;
(5)元素e和f可形成化合物丙(丙的晶胞结构如图乙所示),则丙的化学式为___________ 丙的晶体类型为___________ ,在丙中,每个e原子周围最近的e原子数目为___________ 若晶胞参数为apm,则丙的密度表达式为___________ g・cm-3(用NA表示阿伏加德罗常数的值,丙的摩尔质量为Mg・mol-1)。
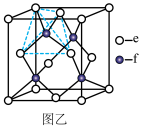

回答下列问题:
(1)a、b、f三种元素的电负性从小到大的顺序为
(2)元素b的单质的一个分子中含有
(3)c单质分别与氟气和氯气形成化合物甲和乙,则甲的熔点
(4)元素d的基态原子的价电子排布式为
(5)元素e和f可形成化合物丙(丙的晶胞结构如图乙所示),则丙的化学式为

您最近一年使用:0次
名校
解题方法
2 . 下列说法中错误的是
| A.一般情况下,含氧酸中非羟基氧数目越多,酸性越强。 |
B.在NH 和[Cu(NH3)4]2+中都存在配位键。 和[Cu(NH3)4]2+中都存在配位键。 |
| C.元素电负性越大的原子,吸引电子的能力越强。 |
| D.SO2、SO3都是极性分子。 |
您最近一年使用:0次
名校
解题方法
3 . 请回答下列有关问题。
(1)Fe元素按周期表分区属于___________ 区元素
(2)地壳中含量最多的三种元素O、Si、Al中,电负性最大的是___________ 。
(3)钠在火焰上灼烧产生的黄光是一种___________ (填字母)
A.吸收光谱 B.发射光谱
(4)Cu的基态原子的电子排布式是___________ 。
(5)钛被称为继铁、铝之后的第三金属,基态钛原子价电子层的电子排布图是___________ 。
(6)基态Fe3+与Fe2+离子中未成对的电子数之比为___________
(7)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________ 。
(8)H2O分子的空间构型为___________
(1)Fe元素按周期表分区属于
(2)地壳中含量最多的三种元素O、Si、Al中,电负性最大的是
(3)钠在火焰上灼烧产生的黄光是一种
A.吸收光谱 B.发射光谱
(4)Cu的基态原子的电子排布式是
(5)钛被称为继铁、铝之后的第三金属,基态钛原子价电子层的电子排布图是
(6)基态Fe3+与Fe2+离子中未成对的电子数之比为
(7)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(8)H2O分子的空间构型为
您最近一年使用:0次
名校
解题方法
4 . W、X、Y、Z、R是五种短周期主族元素,原子序数依次增大。W元素的一种离子与 具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为
具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为 ,X与Z同主族,Z的价电子排布式为3s23p4,下列说法不正确的是
,X与Z同主族,Z的价电子排布式为3s23p4,下列说法不正确的是
 具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为
具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为 ,X与Z同主族,Z的价电子排布式为3s23p4,下列说法不正确的是
,X与Z同主族,Z的价电子排布式为3s23p4,下列说法不正确的是| A.与W生成的气态化合物的热稳定性:Z>Y |
B.W与 的原子半径:W<Li 的原子半径:W<Li |
| C.X和Y的第一电离能:X>Y |
D.X、Z、R的电负性: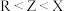 |
您最近一年使用:0次
2022-03-19更新
|
765次组卷
|
10卷引用:辽宁省凤城市第一中学2021-2022学年高二上学期12月月考化学试题
辽宁省凤城市第一中学2021-2022学年高二上学期12月月考化学试题山东省泰安市2020-2021学年高二上学期期末考试化学试题(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版选修3)2月刊 (同步课堂必刷题)(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修2)2月刊 (同步课堂必刷题)陕西省咸阳市实验中学2021-2022学年高二上学期第一次月考化学试题(已下线)化学-2022年高考押题预测卷01(江苏卷)第一章原子结构与性质(基础卷) 山东省菏泽第一中学2022-2023学年高二上学期期末考试化学试题江西省宜春市宜丰中学2023-2024学年高二上学期12月月考化学试题广东省江门市广雅中学2023-2024学年高二下学期3月月考化学试题A卷
5 . Fe、HCN与K2CO3在-定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,下列说法正确的是
| A.电负性由小到大的顺序为O>N>C |
| B.配合物K4Fe(CN)6的中心离子配位数是10 |
| C.1mol HCN分子中含有σ键的数目为2NA,其中碳原子轨道杂化类型是sp杂化 |
D.K4Fe(CN)6的中心离子的价电子排布式为 |
您最近一年使用:0次
6 . X、Y、Z、W为元素周期表前四周期元素,原子序数依次增大,X核外有6种不同运动状态的电子;Y原子基态时2p原子轨道上有3个未成对电子;Z有多种氧化物,其中一种红棕色氧化物可作颜料;W位于第四周期,其原子最外层只有一个电子,且内层都处于全满状态。
回答下列问题:
(1)X在元素周期表中的位置___________ ;
(2)元素X的第一电离能与氢元素比较X___________ H(氢)(填“大于”或“小于”下同),元素的电负性X___________ Y。最简单气态氢化物的沸点X___________ Y;
(3)Z的基态原子核外有___________ 种不同空间运动状态的电子,Z有两种常见的离子,较稳定的是___________ 检验溶液中存在该离子的实验方法___________ 。与Z元素处于同周期同族且原子序数比Z大2的元素Q,写出Q元素+3价阳离子的核外电子排布式___________ 。
(4)W位于元素周期表的___________ 区。
回答下列问题:
(1)X在元素周期表中的位置
(2)元素X的第一电离能与氢元素比较X
(3)Z的基态原子核外有
(4)W位于元素周期表的
您最近一年使用:0次
解题方法
7 . 高压发电系统常用 作为绝缘气体,该气体分子呈正八面体结构,如图所示。下列有关
作为绝缘气体,该气体分子呈正八面体结构,如图所示。下列有关 的说法错误的是
的说法错误的是

 作为绝缘气体,该气体分子呈正八面体结构,如图所示。下列有关
作为绝缘气体,该气体分子呈正八面体结构,如图所示。下列有关 的说法错误的是
的说法错误的是
| A.是非极性分子 |
| B.键角∠FSF都等于90° |
| C.S与F之间共用电子对偏向F |
D.基态硫原子的价电子排布式为 |
您最近一年使用:0次
8 . 近年来,我国航空航天事业成果显著,航空航天材料技术快速发展。
(1)“天宫二号”航天器使用了钛合金,质量轻,强度位于金属之首。钛在周期表中的位置为___ ,基态钛原子的价层电子排布式为___ 。
(2)“北斗三号”导航卫星使用的太阳能电池材料砷化镓是优良的化合物半导体,砷的电负性略___ 镓(填“>”“<”),基态镓原子电子占据最高能级的电子云轮廓图为___ 形。
(3)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。
①下列电子排布图能表示碳原子的最低能量状态的是___ 。碳在成键时,能将一个2s电子激发进入2p能级而参与成键,写出该激发态原子的核外电子排布式___ 。
A.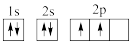 B.
B.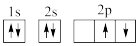
C.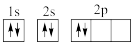 D.
D.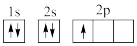
②氧原子的基态原子核外有___ 个未成对电子,有___ 种不同形状的电子云。
(1)“天宫二号”航天器使用了钛合金,质量轻,强度位于金属之首。钛在周期表中的位置为
(2)“北斗三号”导航卫星使用的太阳能电池材料砷化镓是优良的化合物半导体,砷的电负性略
(3)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。
①下列电子排布图能表示碳原子的最低能量状态的是
A.
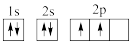 B.
B.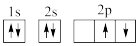
C.
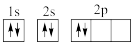 D.
D.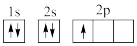
②氧原子的基态原子核外有
您最近一年使用:0次
9 . 在现代工业中,锰及其化合物应用于国民经济的各个领域,其中钢铁工业是最重要的领域,用锰量占90%—95%,主要作为炼铁炼钢过程中的脱氧剂和脱硫剂。在自然界中,锰有II、III、IV及VII价态,对于基态锰原子,下列叙述错误的是
| A.基态锰原子核外电子的运动状态有25种 |
| B.4s电子能量较高,总是在比3s电子离核更远的地方运动 |
| C.电负性比钾高,原子对键合电子的吸引力比钾大 |
| D.锰元素位于周期表的d区 |
您最近一年使用:0次
2021-12-17更新
|
533次组卷
|
2卷引用:辽宁省名校联盟2021-2022学年高二12月联考化学试题
10 . 有A、B、C、D、E五种元素的原子序数依次增大。A、B、C位于同一周期,A原子的第一电离能大于B原子,B原子的2p能级上有两个未成对电子,D位于第四周期且原子的d能级上没有电子,C与D形成的化合物为DC2。E原子的3d能级上电子数是4s能级上电子数的三倍。
(1)写出基态E3+的电子排布式___ 。
(2)A原子第一电离能大于B的原因___ 。
(3)一个A2C2分子中含个___ σ键,___ 个π键;AB 离子的空间构型为
离子的空间构型为___ 。
(4)上述五种元素的原子中电负性由大到小顺序是___ (填元素符号)。
(1)写出基态E3+的电子排布式
(2)A原子第一电离能大于B的原因
(3)一个A2C2分子中含个
 离子的空间构型为
离子的空间构型为(4)上述五种元素的原子中电负性由大到小顺序是
您最近一年使用:0次



