名校
解题方法
1 . 短周期x、y、z、m、n五种主族元素,原子序数依次增大,x元素的某种原子可以在考古时用来测定文物年代。常温时,测得0.1mol/L y、m、n简单氢化物的水溶液pH分别为11、4、1。且z、m还可以与Na形成如图所以结构的化合物。以下有关说法错误的是
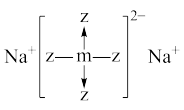
| A.原子半径:z<m<n |
| B.简单氢化物的沸点:x<y<z |
| C.电负性:z>y>x |
| D.x的最高价氧化物中各原子均满足8e-稳定结构 |
您最近一年使用:0次
2022-03-06更新
|
230次组卷
|
2卷引用:河北省邯郸市2021~2022学年高二上学期期末考试化学试题
2 . 前四周期原子序数依次增大的元素a、b、c、d中,a和b的价电子层中未成对电子均只有1个。并且a—和b+的电子数相差8;c和d与b位于同一周期,c和d的价电子层中的未成对电子数分别为4和2,且原子序数相差2。回答下列问题:
(1)a元素在元素周期表中的位置是___________ ,属于___________ 区。
(2)基态b原子中。电子占据最高能层的符号是___________ , 基态b+占据的最高能级共有___________ 个原子轨道。
(3)d元素基态原子的简化电子排布式为___________ 。
(4)a、b、c、d四种元素中,电负性最大的为___________ (填元素符号)。
(5)a、b、d三种元素的第一电离能由大到小的顺序为___________ (填元素符号)。
(6)Mn和c两种元素的部分电离能数据如表所示:
比较两元素的I2、 I3可知,气态Mn2+再失去一个电子比气态c2+再失去一个电子更难,原因是___________ 。
(1)a元素在元素周期表中的位置是
(2)基态b原子中。电子占据最高能层的符号是
(3)d元素基态原子的简化电子排布式为
(4)a、b、c、d四种元素中,电负性最大的为
(5)a、b、d三种元素的第一电离能由大到小的顺序为
(6)Mn和c两种元素的部分电离能数据如表所示:
| 元素 | 电离能/(kJ·mol-1) | ||
| I1 | I2 | I3 | |
| c元素 | 759 | 1561 | 2957 |
| Mn元素 | 717 | 1509 | 3248 |
比较两元素的I2、 I3可知,气态Mn2+再失去一个电子比气态c2+再失去一个电子更难,原因是
您最近一年使用:0次
3 . 重水是含有较多 和
和 的水,重水对工农业生成有很大危害,其中含有
的水,重水对工农业生成有很大危害,其中含有 和
和 的重水叫暂时硬水,含有
的重水叫暂时硬水,含有 、
、 、
、 和
和 等的重水叫永久硬水,回答下面问题:
等的重水叫永久硬水,回答下面问题:
(1)画出Ca原子的原子结构示意图___________ ,硫元素在元素周期表的位置___________ ,属于___________ 区。
(2)写出基态N原子的电子排布式___________ ,画出基态O原子的价电子排布图___________ 。基态N原子的第一电离能比O原子的要大的原因是___________ 。
(3)若将基态镁原子最高能级的电子排布图表示为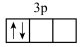 ,则它违背的电子排布规律是
,则它违背的电子排布规律是___________ 、___________ ,基态硫原子核外电子所处最高能级轨道的形状为___________ 。
(4)EDTA是硬水软化常用的化学试剂,与镁离子结合为
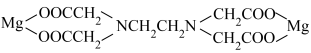
其中C、N、O、Mg四种元素的电负性由大到小的顺序是___________ ,原子半径最大的是___________ (填元素符号,下同),四种元素中基态原子核外单电子数最多的是___________ 。
(5)钙元素与铬元素、铜元素位于同一周期,写出铬、铜基态原子的价电子排布式___________ 、___________ 。
 和
和 的水,重水对工农业生成有很大危害,其中含有
的水,重水对工农业生成有很大危害,其中含有 和
和 的重水叫暂时硬水,含有
的重水叫暂时硬水,含有 、
、 、
、 和
和 等的重水叫永久硬水,回答下面问题:
等的重水叫永久硬水,回答下面问题:(1)画出Ca原子的原子结构示意图
(2)写出基态N原子的电子排布式
(3)若将基态镁原子最高能级的电子排布图表示为
 ,则它违背的电子排布规律是
,则它违背的电子排布规律是(4)EDTA是硬水软化常用的化学试剂,与镁离子结合为
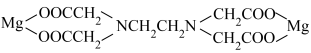
其中C、N、O、Mg四种元素的电负性由大到小的顺序是
(5)钙元素与铬元素、铜元素位于同一周期,写出铬、铜基态原子的价电子排布式
您最近一年使用:0次
名校
解题方法
4 . 如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
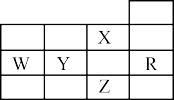
| A.W元素的第一电离能大于Y元素的第一电离能 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.p能级未成对电子最多的是Z元素 |
| D.X元素是电负性最大的元素 |
您最近一年使用:0次
2022-04-19更新
|
175次组卷
|
3卷引用:河北省石家庄市第二十三中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
5 . VCU研发的锂超离子导体Li3SBF4,提升了固态电解质导电性,其制备反应为LiBF4+Li2S=Li3SBF4。
回答下列问题:
(1)基态硫原子中核外电子有____ 种运动状态;组成锂超离子导体的四种元素中,电负性最大的元素的价层电子排布式为____ 。
(2)S的常见含氧酸有H2SO3和H2SO4,其中酸根离子呈三角锥形结构的酸是____ (填化学式),该分子的中心原子的价层电子对数是____ ;含F有机酸CF3COOH比CCl3COOH的酸性____ (填“强”或“弱”),原因为____ 。
(3)BF3与F-形成 时,二者形成的化学键为
时,二者形成的化学键为____ 键,提供电子对的原子为____ (填元素符号), 中B的杂化方式为
中B的杂化方式为____ 。
(4)另一种含锂电极材料LiFePO4的晶胞结构如图所示,晶胞参数分别为anm、bnm、cnm,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构,每个晶胞中含Fe和P的数目分别为___ 、___ ;设NA为阿伏加德罗常数的值,LiFePO4的密度ρ=___ g•cm-3(用含a、b、c、NA的代数式表示)。
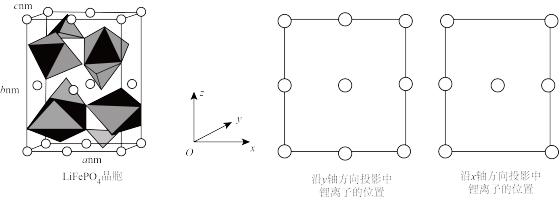
回答下列问题:
(1)基态硫原子中核外电子有
(2)S的常见含氧酸有H2SO3和H2SO4,其中酸根离子呈三角锥形结构的酸是
(3)BF3与F-形成
 时,二者形成的化学键为
时,二者形成的化学键为 中B的杂化方式为
中B的杂化方式为(4)另一种含锂电极材料LiFePO4的晶胞结构如图所示,晶胞参数分别为anm、bnm、cnm,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构,每个晶胞中含Fe和P的数目分别为

您最近一年使用:0次
6 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元它们的原子序数依次增大。请根据下列相关信息,回答问题:
(1)写出A的元素符号____ ,D的元素名称____ 。
(2)B基态原子中能量最高的电子,其电子云在空间有____ 个方向,原子轨道呈____ 形。
(3)某同学根据上述信息,推断C基态原子的核外轨道表示式为 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了____ 。
(4)E元素原子核外有____ 种运动状态不同的电子。
(5)G位于____ 族____ 区,价电子排布式为____ 。
(6)检验F元素的方法是____ ,请用原子结构的知识解释产生此现象的原因是____ 。
| A元素原子半径在元素周期表中最小,也是宇宙中最丰富的元素 |
| B元素原子的核外p能级总电子数比s能级总电子数少1个 |
| C元素原子的第一至第四电离能分别是I1=738kJ·mol-1;I2=l451kJ·mol-1;I3=7733kJ·mol-1;I4=10540kJ·mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4,原子半径同周期最小 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外轨道表示式为
 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了(4)E元素原子核外有
(5)G位于
(6)检验F元素的方法是
您最近一年使用:0次
名校
解题方法
7 . 现有几种元素的基态离子(W-、X2-、Y+、Z3+),其核外电子排布式均为1s12s22p6,下列有关叙述正确的是
| A.电负性:W>X>Y>Z |
| B.最高正化合价:W>X>Z>Y |
| C.原子半径:Y>Z>X>W |
| D.第一电离能:W>X>Z>Y |
您最近一年使用:0次
2022-06-03更新
|
103次组卷
|
2卷引用:河北省保定市名校2021-2022学年高二下学期第二次联考(B2)化学试题
8 . 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态F原子核外电子的运动状态有_______ 种。
(2)O、F、Cl电负性由小到大的顺序为_______ 。
(3) 分子中心原子杂化方式为
分子中心原子杂化方式为_______ 杂化;其分子的空间构型为_______ ; 的熔、沸点
的熔、沸点_______ (填“高于”或“低于”) ,原因是
,原因是_______ 。
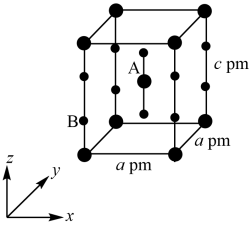
(4)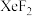 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_______ 个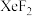 分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为 (
分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为 ( ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为_______ 。
(1)基态F原子核外电子的运动状态有
(2)O、F、Cl电负性由小到大的顺序为
(3)
 分子中心原子杂化方式为
分子中心原子杂化方式为 的熔、沸点
的熔、沸点 ,原因是
,原因是(4)
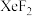 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有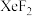 分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为 (
分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为 ( ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
9 . 现有对四种元素的叙述如下:
①元素X的基态原子的价电子排布式3s23p1
②元素Y的基态原子的原子结构示意图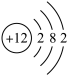
③元素Z的基态原子Z3-的轨道表示式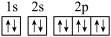
④元素T的基态原子有两个电子层,电子式为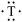
则下列有关比较中正确的是( )
①元素X的基态原子的价电子排布式3s23p1
②元素Y的基态原子的原子结构示意图

③元素Z的基态原子Z3-的轨道表示式

④元素T的基态原子有两个电子层,电子式为
则下列有关比较中正确的是( )
| A.第一电离能:T>Z>X>Y |
| B.简单离子半径:Z>T>Y>X |
| C.电负性:Z>T>Y>X |
| D.最高正化合价:T>Z>X>Y |
您最近一年使用:0次
2020-03-07更新
|
335次组卷
|
5卷引用:河北省石家庄市第二十三中学2021-2022学年高二下学期期中考试化学试题
10 . 3-乙基吡啶(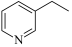 )是一种重要的有机合成中间体,具有芳香性。回答下列问题:
)是一种重要的有机合成中间体,具有芳香性。回答下列问题:
(1)3-乙基吡啶中所含元素电负性由大到小的顺序为____ ;其中碳原子的杂化方式为____ 。
(2)3-乙基吡的沸点高于2,6-二甲基吡啶(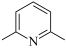 ),分析可能的原因为
),分析可能的原因为____ 。
(3)吡啶(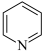 )的键合情况和苯类似,所以与苯有类似的性质,既能发生加成反应,又能发生取代反应;其中发生取代反应时,N间位碳原子上的氢原子要比邻位和对位活泼。1mol3-乙基吡啶最多能与
)的键合情况和苯类似,所以与苯有类似的性质,既能发生加成反应,又能发生取代反应;其中发生取代反应时,N间位碳原子上的氢原子要比邻位和对位活泼。1mol3-乙基吡啶最多能与____ molH2发生加成反应;3-乙基吡啶与浓硫酸、浓硝酸混合,在一定条件下发生硝化反应的方程式为___ 。
(4)3-乙基吡啶有多种同分异构体,其中含苯环的同分异构体有____ 种(不考虑立体异构),其中核磁共振氢谱有4组峰的结构简式为____ 。
 )是一种重要的有机合成中间体,具有芳香性。回答下列问题:
)是一种重要的有机合成中间体,具有芳香性。回答下列问题:(1)3-乙基吡啶中所含元素电负性由大到小的顺序为
(2)3-乙基吡的沸点高于2,6-二甲基吡啶(
 ),分析可能的原因为
),分析可能的原因为(3)吡啶(
 )的键合情况和苯类似,所以与苯有类似的性质,既能发生加成反应,又能发生取代反应;其中发生取代反应时,N间位碳原子上的氢原子要比邻位和对位活泼。1mol3-乙基吡啶最多能与
)的键合情况和苯类似,所以与苯有类似的性质,既能发生加成反应,又能发生取代反应;其中发生取代反应时,N间位碳原子上的氢原子要比邻位和对位活泼。1mol3-乙基吡啶最多能与(4)3-乙基吡啶有多种同分异构体,其中含苯环的同分异构体有
您最近一年使用:0次



