| 元素 | X | Y | Z | W |
| 最高价氧化物的水化物 | H3ZO4 | |||
 溶液对应的pH(25℃) 溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
| A.元素电负性:Z<W | B.简单离子半径:W<Y |
| C.元素第一电离能:Z<W | D.简单氢化物的沸点:X<Z |
| A.Zn处于元素周期表中的d区 |
| B.Ge的价层电子排布式为3d104s24p4 |
| C.基态O原子中成对电子数是未成对电子数的2倍 |
| D.三种元素电负性由大到小的顺序:O>Ge>Zn |
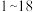 号元素的离子
号元素的离子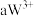 、
、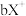 、
、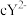 、
、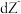 都具有相同电子层结构,下列关系正确的是
都具有相同电子层结构,下列关系正确的是A.质子数: ,离子的还原性: ,离子的还原性: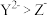 |
B.电负性: |
C.氢化物的稳定性: |
D.原子半径: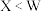 ,第一电离能: ,第一电离能: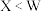 |
4 . 根据信息回答下列问题:
(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
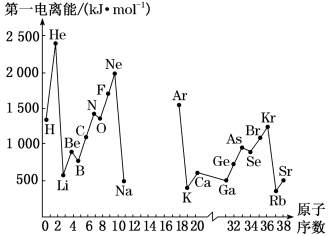
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为
②图中Ge元素中未成对电子有
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出部分元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①根据表中给出的数据,可推知元素的电负性具有的变化规律
②通过分析电负性值变化规律,确定Al元素电负性值的最小范围
③判断下列物质是离子化合物还是共价化合物:
A Li3N B PCl3 C MgCl2 D SiC
Ⅰ.属于离子化合物的是
Ⅱ.属于共价化合物的是
请设计一个实验方案证明上述所得到的结论
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。
则下列有关比较中正确的是
| A.第一电离能:③>②>① |
| B.原子半径:③>②>① |
| C.电负性:③>②>① |
| D.最高正化合价:③>②>① |
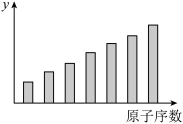
| A.y轴表示的可能是第一电离能 |
| B.y轴表示的可能是电负性 |
| C.y轴表示的可能是原子半径 |
| D.y轴表示的可能是形成基态离子转移的电子数 |
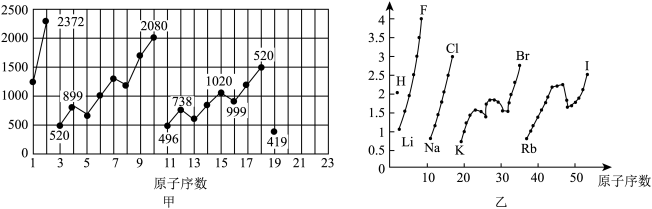
| A.图乙不可能表示元素的电负性随原子序数的变化关系 |
| B.图甲可能表示的是元素单质的熔点随原子序数的变化关系 |
| C.图乙可能表示的是元素原子的半径随原子序数的变化关系 |
| D.图甲可能表示的是元素原子的第一电离能随原子序数的变化关系 |
回答下列问题:
(1)C、O、Cl三种元素电负性由大到小的顺序为
(2)基态Na原子中,核外不同电子运动状态的数目为
(3)
 的空间结构为
的空间结构为
(4)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为

 ,由
,由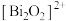 和
和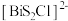 交替堆叠构成。已知
交替堆叠构成。已知 位于第六周期VA族,下列有关说法错误的是
位于第六周期VA族,下列有关说法错误的是A. 的价电子排布式为 的价电子排布式为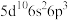 |
B.有关元素的电负性: |
C. 属于含共价键的离子化合物 属于含共价键的离子化合物 |
| D.该新型超导体的组成元素全部位于元素周期表p区 |
(1)铜元素基态原子的价电子排布式为
(2)铜元素能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。
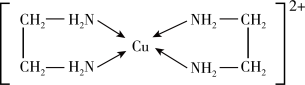
①Cu2+与乙二胺所形成的配离子内部粒子间的作用力类型有
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
②乙二胺分子中氮原子的杂化轨道类型为
③乙二胺和三甲胺 [N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是
(4)Cu和S形成某种晶体的晶胞如图所示。
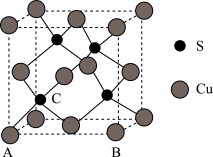
①该晶体的化学式为
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为
③已知该晶体的密度为 dg•cm-3,Cu2+和S2-的半径分别为apm和bpm,阿伏加 德罗常数值为NA。列式表示该晶体中原子的空间利用率



