名校
1 . 第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。如下图所示是部分元素原子的第一电离能(I1)随原子序数变化的曲线图。
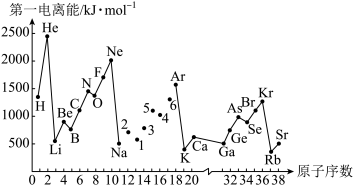
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na~Ar八种元素用短线连接起来,构成完整的图象______ 。
(2)从上图分析可知,同 一主族元素的第一电离能(I1)变化规律是___________ 。
(3)上图中5号元素在元素周期表中的位置是___________ 。
(4)上图中4、5、6号三种元素中电负性最大的是___________ (填元素符号)。

请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na~Ar八种元素用短线连接起来,构成完整的图象
(2)从上图分析可知,同 一主族元素的第一电离能(I1)变化规律是
(3)上图中5号元素在元素周期表中的位置是
(4)上图中4、5、6号三种元素中电负性最大的是
您最近一年使用:0次
名校
2 . 中科院大连化物所化学研究团队在化学链合成NH3研究方面取得新进展,该研究中涉及的物质有Ni-BaH2/Al2O3、Fe-K2O-Al2O3、Cs-Ru/MgO等,相关研究成果发表于《自然》上。请回答下列问题:
(1)Fe的基态原子共有_______ 种不同能级的电子,其最高能级的电子云形状是_______ 。
(2)氮原子的电子排布图表示的状态中,能量最低的是_______(填字母)。
(3)一种含Cu、S元素的有机物的结构简式如图所示,N原子的杂化方式为_______ 。
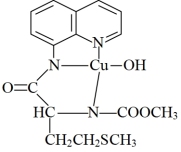
(4)元素的第一电离能:Mg_______ (填“>”或“<”)Al;N、O的电负性由大到小的顺序为_______ (用元素符号表示)。
(5)某镍白铜合金的立方晶胞结构如图所示:
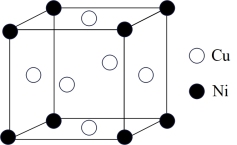
①该合金的化学式为_______ 。
②若该合金的晶胞边长为anm,则该合金的密度为_______ g·cm-3(设NA为阿伏加德罗常数的值)。
(1)Fe的基态原子共有
(2)氮原子的电子排布图表示的状态中,能量最低的是_______(填字母)。
A.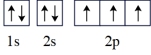 | B.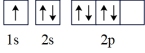 |
C.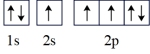 | D.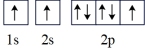 |

(4)元素的第一电离能:Mg
(5)某镍白铜合金的立方晶胞结构如图所示:

①该合金的化学式为
②若该合金的晶胞边长为anm,则该合金的密度为
您最近一年使用:0次
解题方法
3 . 下列关于配合物 的说法中正确的是
的说法中正确的是
 的说法中正确的是
的说法中正确的是A.在 中, 中, 给出孤电子对, 给出孤电子对, 提供空轨道 提供空轨道 |
B. 组成元素中电负性最大的元素是氮元素 组成元素中电负性最大的元素是氮元素 |
| C.阴离子的空间结构是平面正方形 |
D. 的空间构型为正四面体形 的空间构型为正四面体形 |
您最近一年使用:0次
解题方法
4 . Al及其化合物在生产生活中有广泛应用。
回答下列问题:
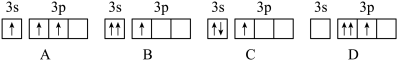
(1)运-20的外壳使用了铝合金:Mg-Al-Mn,下列选项中能表示基态Al原子价层电子排布图的是______ 。(填选项字母);第一电离能:铝______ (填“大于”“等于”或“小于”)镁。
(2)三乙基铝是一种金属有机物,可做火箭燃料,其结构简式为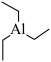 。
。
①三乙基铝熔点为-52.5℃,其晶体类型为______ 。
②三乙基铝中Al的VSEPR模型为______ ,C原子的杂化方式为______ 。
③三乙基铝中所含元素的电负性从大到小的顺序为______ (用元素符号表示)。
(3)工业上冶炼铝时需加入助熔剂冰晶石(Na3AlF6),[AlF6]3-中的中心原子的配位数为______ 。
(4)AlP晶胞结构与Si的类似,如图所示:
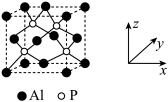
①磷化铝晶胞沿着x轴的投影图为______ (填选项字母)。
②若磷化铝的晶胞边长为a pm,NA表示阿伏加德罗常数的值,则AlP晶体密度为______ g/cm3(用含NA、a的最简代数式表示)。
回答下列问题:
(1)运-20的外壳使用了铝合金:Mg-Al-Mn,下列选项中能表示基态Al原子价层电子排布图的是

(2)三乙基铝是一种金属有机物,可做火箭燃料,其结构简式为
 。
。①三乙基铝熔点为-52.5℃,其晶体类型为
②三乙基铝中Al的VSEPR模型为
③三乙基铝中所含元素的电负性从大到小的顺序为
(3)工业上冶炼铝时需加入助熔剂冰晶石(Na3AlF6),[AlF6]3-中的中心原子的配位数为
(4)AlP晶胞结构与Si的类似,如图所示:

①磷化铝晶胞沿着x轴的投影图为

②若磷化铝的晶胞边长为a pm,NA表示阿伏加德罗常数的值,则AlP晶体密度为
您最近一年使用:0次
2022-12-24更新
|
145次组卷
|
2卷引用:河北省衡水市2022-2023学年高三上学期12月份大联考化学试卷
5 . ⅤA族元素及其化合物在生产、生活中用途广泛。
(1)①P4S3常用于制造火柴,P和S的第一电离能较大的是____ 。
②As4S4俗称雄黄,其中基态As原子的核外电子排布式为[Ar]____ ,有____ 个未成对电子。
③P、S、As电负性由大到小的顺序是____ 。
(2)NH3、PH3、AsH3中沸点最高的是___ ,其主要原因是____ 。
(3)白磷在氯气中燃烧可以得到PCl3和PCl5,其中气态PCl3分子的立体构型为___ 。
(4)锑酸亚铁晶胞如图所示,其晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°,则:
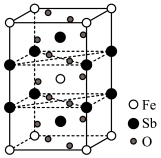
①锑酸亚铁的化学式为____ 。
②晶体的密度为___ g·cm-3(设NA为阿伏加德罗常数的值)。
(1)①P4S3常用于制造火柴,P和S的第一电离能较大的是
②As4S4俗称雄黄,其中基态As原子的核外电子排布式为[Ar]
③P、S、As电负性由大到小的顺序是
(2)NH3、PH3、AsH3中沸点最高的是
(3)白磷在氯气中燃烧可以得到PCl3和PCl5,其中气态PCl3分子的立体构型为
(4)锑酸亚铁晶胞如图所示,其晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°,则:

①锑酸亚铁的化学式为
②晶体的密度为
您最近一年使用:0次
解题方法
6 . 铜是人类最早使用的金属之一,用黄铜矿(主要成分为CuFeS2)生产粗铜的反应原理如下:
CuFeS2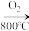 Cu2S
Cu2S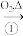 Cu2O
Cu2O Cu
Cu
回答下列问题:
(1)第三周期主族元素中电负性比S小的元素有___________ 种,H2S 分子的空间结构名称为___________ ,H2S的沸点比H2O的___________ (填“高”或“低”),原因是___________ 。
(2)Cu2O和Cu2S均为___________ 晶体,Cu2O 的熔点为1235 °C ,Cu2S的熔点为1130 °C ,Cu2O熔点较高的原因是___________ 。
(3)反应①、②中会生成气体SO2,其中心原子的杂化方式为___________ 。
(4)铜的两种氧化物的晶胞如图1、图2所示,图1表示___________ (填化学式),图2中,A原子坐标参数为(0,0,0),B原子为( ,
, ,
, )则C原子的坐标参数为
)则C原子的坐标参数为____ 。 若图2表示的晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则图2晶胞中Cu原子与O原子之间的最小距离为____ (用含ρ和NA的式子表示)pm。
CuFeS2
 Cu2S
Cu2S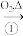 Cu2O
Cu2O Cu
Cu回答下列问题:
(1)第三周期主族元素中电负性比S小的元素有
(2)Cu2O和Cu2S均为
(3)反应①、②中会生成气体SO2,其中心原子的杂化方式为
(4)铜的两种氧化物的晶胞如图1、图2所示,图1表示
 ,
, ,
, )则C原子的坐标参数为
)则C原子的坐标参数为
您最近一年使用:0次
名校
7 . 三醋酸锰[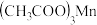 ]是一种很好的有机反应氧化剂,可用如下反应制备:
]是一种很好的有机反应氧化剂,可用如下反应制备: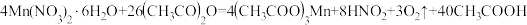 。请回答下列问题:
。请回答下列问题:
(1)三醋酸锰[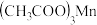 ]中阳离子的价层电子排布式为
]中阳离子的价层电子排布式为_______ ,该价层电子排布式中电子的自旋状态_______ (填“相同”或“相反”)。
(2)过渡元素锰能形成很多重要的配合物。三醋酸锰就是一种配合物,其结构如图所示,其中配位键数为_______ 。

(3)Mn2+能形成配离子为八面体的配合物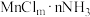 ,在该配合物的配离子中,Mn2+位于八面体的中心。若含1mol该配合物的溶液与足量
,在该配合物的配离子中,Mn2+位于八面体的中心。若含1mol该配合物的溶液与足量 溶液作用可生成
溶液作用可生成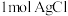 沉淀,则化学式中的n为
沉淀,则化学式中的n为_______ 。
(4) 中所含元素的电负性由大到小的顺序为
中所含元素的电负性由大到小的顺序为_______ (用元素符号表示)。
(5) 的立体构型是
的立体构型是_____ ,醋酸酐[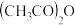 ]中所含σ键数与π键数之比为
]中所含σ键数与π键数之比为____ 。
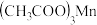 ]是一种很好的有机反应氧化剂,可用如下反应制备:
]是一种很好的有机反应氧化剂,可用如下反应制备: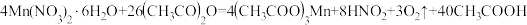 。请回答下列问题:
。请回答下列问题:(1)三醋酸锰[
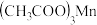 ]中阳离子的价层电子排布式为
]中阳离子的价层电子排布式为(2)过渡元素锰能形成很多重要的配合物。三醋酸锰就是一种配合物,其结构如图所示,其中配位键数为

(3)Mn2+能形成配离子为八面体的配合物
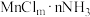 ,在该配合物的配离子中,Mn2+位于八面体的中心。若含1mol该配合物的溶液与足量
,在该配合物的配离子中,Mn2+位于八面体的中心。若含1mol该配合物的溶液与足量 溶液作用可生成
溶液作用可生成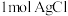 沉淀,则化学式中的n为
沉淀,则化学式中的n为(4)
 中所含元素的电负性由大到小的顺序为
中所含元素的电负性由大到小的顺序为(5)
 的立体构型是
的立体构型是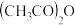 ]中所含σ键数与π键数之比为
]中所含σ键数与π键数之比为
您最近一年使用:0次
8 . 下列说法不正确的是
| A.HClO4酸性强于HClO |
| B.某元素气态基态原子的逐级电离能(kJ/mol)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+ |
| C.Na、P、Cl的电负性依次增大 |
| D.CH3CH(OH)COOH分子中有2个手性碳原子 |
您最近一年使用:0次
9 . 下列说法中,正确的是
| A.原子序数为16的元素处于周期表的第三周期IVA族 |
| B.第一电离能的大小可以作为判断金属性强弱的依据 |
| C.共价化合物中,电负性大的成键元素通常表现为负价 |
| D.第三周期的金属元素从左到右,元素的金属性依次增强 |
您最近一年使用:0次
2022-04-19更新
|
74次组卷
|
2卷引用:河北正中实验中学2021-2022学年高二下学期开学考试化学试题
名校
解题方法
10 . 邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。下列相关说法正确的是
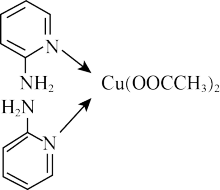

A.Cu原子的价电子排布图为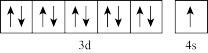 |
| B.组成该配合物的第二周期元素的电负性大小顺序为N>O>C |
| C.所有N原子的杂化方式相同,所有C原子的杂化方式也相同 |
D. 分子中可能有13个原子在同一平面上 分子中可能有13个原子在同一平面上 |
您最近一年使用:0次



