名校
解题方法
1 . 亚砷酸钠(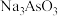 ),易溶于水,主要用作杀虫剂、防腐剂、分析试剂等。利用
),易溶于水,主要用作杀虫剂、防腐剂、分析试剂等。利用 (分子结构如图)制备亚砷酸钠涉及以下反应:
(分子结构如图)制备亚砷酸钠涉及以下反应: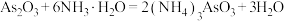 。下列说法错误的是
。下列说法错误的是
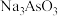 ),易溶于水,主要用作杀虫剂、防腐剂、分析试剂等。利用
),易溶于水,主要用作杀虫剂、防腐剂、分析试剂等。利用 (分子结构如图)制备亚砷酸钠涉及以下反应:
(分子结构如图)制备亚砷酸钠涉及以下反应: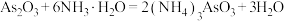 。下列说法错误的是
。下列说法错误的是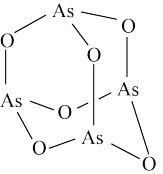
A. 的电子式为 的电子式为 |
B.砷的原子结构示意图为 |
C.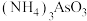 中所含元素的电负性由大到小的顺序为N>O>H>As 中所含元素的电负性由大到小的顺序为N>O>H>As |
D.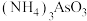 中阳离子的空间结构为正四面体形 中阳离子的空间结构为正四面体形 |
您最近一年使用:0次
2023-05-10更新
|
352次组卷
|
3卷引用:江西省南昌市第十九中学2023-2024学年高三上学期11月期中考试化学试卷
江西省南昌市第十九中学2023-2024学年高三上学期11月期中考试化学试卷 湖南省郴州市2023届高三适应性模拟考试(三模)化学试题(已下线)专题02 化学用语的正误判断-2023年高考化学真题题源解密(全国通用)
名校
解题方法
2 . 某离子化合物中的阳离子结构模型如图。已知X、Y、Z为原子序数依次增大的短周期元素,Z的核外成对电子数和未成对电子数之比为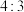 。下列说法错误的是
。下列说法错误的是
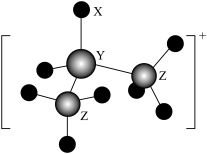
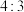 。下列说法错误的是
。下列说法错误的是
| A.X、Y、Z原子的电负性大小为Z>X>Y |
| B.1mol该阳离子所含的配位键数为2NA(NA为阿伏加德罗常数的值) |
| C.该阳离子可与水中的氢原子形成氢键 |
| D.X分别能与Y、Z形成正四面体形的离子 |
您最近一年使用:0次
2023-05-07更新
|
776次组卷
|
4卷引用:江西省宜春市丰城市第九中学2023-2024学年高三上学期12月月考化学试题
江西省宜春市丰城市第九中学2023-2024学年高三上学期12月月考化学试题湖南省长沙市长郡中学2022-2023学年高三模拟试卷(一)化学试题(已下线)考点巩固卷05 物质结构 元素周期律(2大考点50题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)
解题方法
3 . 硫、锌分别是人体必须的常量元素和微量元素,在生产中有着广泛应用。回答下列问题。
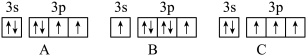
(1)基态硫原子的价电子排布式为___________ ,共有___________ 个未成对电子。下列状态的硫原子中,电离最外层1个电子所需能量最低的是___________ (填标号)。
(2)S与O同族,H2S与H2O空间构型相同,都是2对孤电子对,但H2O分子中的键角比H2S分子中的键角大,请从成键电子对之间相互排斥的角度解释其原因___________ 。
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有___________ ,下表是2种二烃基锌的沸点数据,则烃基R1是___________ ,推断的依据,是___________ 。
(4)闪锌矿硫化锌的晶胞结构如图所示。硫离子呈立方最密堆积,Zn2+填入S2-组成___________ 空隙中(填“正四面体”或“正八面体”);NA为阿伏加德罗常数,若晶体的密度为ρg/cm3,则S2-离子之间最短核间距离为___________ pm(用含ρ、NA的代数式表示)。
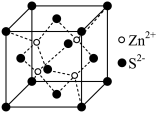
(1)基态硫原子的价电子排布式为

(2)S与O同族,H2S与H2O空间构型相同,都是2对孤电子对,但H2O分子中的键角比H2S分子中的键角大,请从成键电子对之间相互排斥的角度解释其原因
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有
| 物质 | R1-Zn-R1 | C2H5-Zn-C2H5 |
| 沸点(°C) | 46 | 118 |

您最近一年使用:0次
2023-03-14更新
|
775次组卷
|
3卷引用:江西省景德镇市2023届高三下学期第二次综合模拟考试理综化学试题
2022高三·全国·专题练习
4 . 短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是
| A.X能与多种元素形成共价键 | B.简单氢化物沸点: |
C.第一电离能: | D.电负性: |
您最近一年使用:0次
2022-07-06更新
|
9649次组卷
|
33卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期11月期中考试化学试题
江西省宜春市宜丰中学2023-2024学年高三上学期11月期中考试化学试题北京清华附中2022-2023学年高三上学期10月统练(三)化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)题型9 元素“位—构-性”关系的综合应用-高考必备50个题型(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用) 天津市静海区第一中学2023-2024学年高三上学期12月月考化学试题(已下线)专题06 物质结构元素周期律-2022年高考真题模拟题分项汇编(已下线)2022年辽宁省高考真题化学试题(部分试题)(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)2022年辽宁高考真题化学试题(已下线)2022年辽宁省高考真题变式题(1-10)(已下线)第29讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点13 原子结构与核外电子排布-备战2023年高考化学考试易错题(已下线)第36讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破吉林省长春市第五中学2022-2023学年高二上学期期末考试化学试题河南省鹤壁市高中2022-2023学年高二下学期第一次段考化学试题(已下线)2022年辽宁高考真题化学试题变式题(选择题1-5)天津市和平区2022-2023学年高二下学期期末质量调查化学试题天津市第一中学2022-2023学年高二上学期期末考试化学试题河北省遵化市第一中学2023-2024学年高二上学期月考2化学试题天津市和平区2023-2024学年高三下学期第一次质量调查化学试卷湖南省浏阳景雅高级中学2024届高三下学期5月全真仿真模拟考试化学试题吉林省长春外国语学校2021-2022学年高二下学期期末考试化学试题吉林省长春市第二实验中学2023-2024学年高二下学期开学考试化学试题内蒙古呼和浩特市剑桥中学2023-2024学年高二下学期3月月考化学试题(已下线)专题01 物质的结构与性质-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)(已下线)综合01 物质结构与性质压轴80题-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)天津市第五十五中学2023-2024学年高二下学期期中学情调研化学试卷河北省石家庄市第一中学2023-2024学年高二下学期5月月考化学试题
5 . 某抗癌药物的结构简式如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y同主族,Z的最外层电子数等于W的核外电子数。下列叙述正确的是
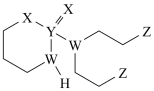

| A.W位于第二周期IIIA族 |
| B.基态Y原子只有1个未成对电子 |
| C.W、Z的最简单氢化物混合物的沸点,前者小于后者 |
| D.电负性:W>Y |
您最近一年使用:0次
2022-06-03更新
|
192次组卷
|
2卷引用:江西省丰城中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
6 . 已知P4单质、次磷酸的结构如图,P4在KOH溶液中的变化是: P4+3KOH+3H2O═3KH2PO2+PH3↑,下列说法正确的是
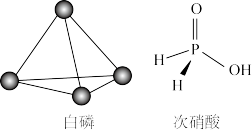

| A.PH3分子中所有的原子可能共平面 |
| B.31 g P4含有1.5NA个P﹣P |
| C.元素的电负性大小顺序:P>O>H>K |
| D.KH2PO2属于酸式盐 |
您最近一年使用:0次
2022-04-29更新
|
119次组卷
|
4卷引用:江西省宜春市丰城市第九中学2023-2024学年高三上学期开学考化学试题
解题方法
7 . 铑的配合物Rh(PPh3)Cl可催化丙烯与氢气的加成,反应过程为:CH3CH=CH2+H2 CH3CH2CH3,回答下列问题:
CH3CH2CH3,回答下列问题:
(1)基态Rh原子的价电子排布式为4d85s1,铑在周期表的位置是_______ ,其原子中的未成对电子数为_______ 。
(2) 1mol丙烯(CH3CH=CH2)中σ键的数目为_______ ,其结构简式中打点的C原子与H原子间的σ键可称为sp2-sσ键,则丙烯分子中C原子之间的所有σ键可称为_______ 。
(3)第一电离能P_______ Cl (填“大于”或“小于”),PPh3是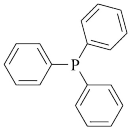 的缩写,该分子的立体构型是
的缩写,该分子的立体构型是_______ 。比较PPh3与PH3的沸点大小,并说明原因_______ 。
(4) RhCl3的晶胞结构中Rh3+的位置如图所示(Cl-未画出):
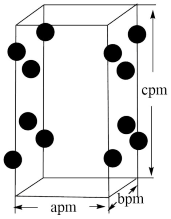
①晶胞中含有的Cl-数目为_______ ;
②若阿伏加德罗常数为NA,则晶体的密度为_______ g·cm-3.(列出计算式)
 CH3CH2CH3,回答下列问题:
CH3CH2CH3,回答下列问题:(1)基态Rh原子的价电子排布式为4d85s1,铑在周期表的位置是
(2) 1mol丙烯(CH3CH=CH2)中σ键的数目为
(3)第一电离能P
 的缩写,该分子的立体构型是
的缩写,该分子的立体构型是(4) RhCl3的晶胞结构中Rh3+的位置如图所示(Cl-未画出):

①晶胞中含有的Cl-数目为
②若阿伏加德罗常数为NA,则晶体的密度为
您最近一年使用:0次
2021-05-31更新
|
261次组卷
|
2卷引用:江西省新余市2023届高三下学期第二次模拟考试理科综合化学试题



