解题方法
1 . 国产大飞机C919的制造使用了较多含硼材料(如硼纤维、氮化硼等),多项技术打破了外国垄断。
(1)立方氮化硼硬度大,熔点为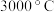 ,其晶体类型为
,其晶体类型为_______ 。
(2)耐高温材料立方 制备流程中用到
制备流程中用到 、
、 和触媒剂
和触媒剂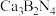 。
。
① 、B、N三种元素电负性从大到小的顺序为
、B、N三种元素电负性从大到小的顺序为_______ 。
② 中
中 原子的
原子的_______ 轨道与 原子的
原子的_______ 轨道形成 键;形成
键;形成 过程中,基态
过程中,基态 原子价电子层上的电子先激发,再杂化,激发后
原子价电子层上的电子先激发,再杂化,激发后 原子的价电子轨道表示式为
原子的价电子轨道表示式为_______ 。
③ 在四氯化碳中的溶解度远大于
在四氯化碳中的溶解度远大于 ,原因是
,原因是_______ 。
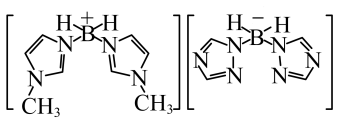
(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有_______ (填字母)。 键 E.
键 E. 键 F.氢键
键 F.氢键
(4)硼化钙晶胞结构如图所示, 原子构成
原子构成 正八面体,各个顶点通过
正八面体,各个顶点通过 键互相连接成三维骨架,八个
键互相连接成三维骨架,八个 多面体围成立方体,中心为
多面体围成立方体,中心为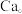 硼化钙的化学式为
硼化钙的化学式为_______ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。已知 原子的分数坐标为
原子的分数坐标为 ,
, 正八面体中
正八面体中 键的键长为r
键的键长为r ,晶胞参数为a
,晶胞参数为a ,则
,则 点原子的分数坐标为
点原子的分数坐标为_______ 。
(1)立方氮化硼硬度大,熔点为
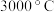 ,其晶体类型为
,其晶体类型为(2)耐高温材料立方
 制备流程中用到
制备流程中用到 、
、 和触媒剂
和触媒剂 。
。①
 、B、N三种元素电负性从大到小的顺序为
、B、N三种元素电负性从大到小的顺序为②
 中
中 原子的
原子的 原子的
原子的 键;形成
键;形成 过程中,基态
过程中,基态 原子价电子层上的电子先激发,再杂化,激发后
原子价电子层上的电子先激发,再杂化,激发后 原子的价电子轨道表示式为
原子的价电子轨道表示式为③
 在四氯化碳中的溶解度远大于
在四氯化碳中的溶解度远大于 ,原因是
,原因是(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有
 键 E.
键 E. 键 F.氢键
键 F.氢键(4)硼化钙晶胞结构如图所示,
 原子构成
原子构成 正八面体,各个顶点通过
正八面体,各个顶点通过 键互相连接成三维骨架,八个
键互相连接成三维骨架,八个 多面体围成立方体,中心为
多面体围成立方体,中心为 硼化钙的化学式为
硼化钙的化学式为 原子的分数坐标为
原子的分数坐标为 ,
, 正八面体中
正八面体中 键的键长为r
键的键长为r ,晶胞参数为a
,晶胞参数为a ,则
,则 点原子的分数坐标为
点原子的分数坐标为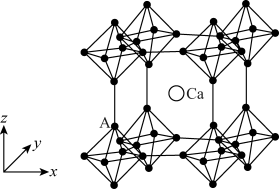
您最近一年使用:0次
2 . 镓 、铟
、铟 都是典型的稀有分散元素。回答下列问题:
都是典型的稀有分散元素。回答下列问题:
(1)基态 原子的核外价电子排布式为
原子的核外价电子排布式为_____ ,最高能级电子的电子云形状为_____ 。
(2)一种含镓药物的合成方法如图所示: 原子的杂化方式为
原子的杂化方式为_____ , 化合物
化合物 中含有的
中含有的 键的物质的量为
键的物质的量为_____ 。化合物Ⅰ中所含元素的电负性由大到小的顺序为_____ (用元素符号表示)。
②化合物Ⅱ中 的配位数为
的配位数为_____ ,
_____ 。
(3)一种由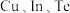 组成的晶体属四方晶系,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞棱边夹角均为 ,其晶胞结构如图。
,其晶胞结构如图。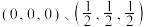 。则C点原子的分数坐标为
。则C点原子的分数坐标为_____ 。
② 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为_____ (用含 的代数式表示)
的代数式表示) 。
。
 、铟
、铟 都是典型的稀有分散元素。回答下列问题:
都是典型的稀有分散元素。回答下列问题:(1)基态
 原子的核外价电子排布式为
原子的核外价电子排布式为(2)一种含镓药物的合成方法如图所示:

 原子的杂化方式为
原子的杂化方式为 化合物
化合物 中含有的
中含有的 键的物质的量为
键的物质的量为②化合物Ⅱ中
 的配位数为
的配位数为
(3)一种由
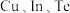 组成的晶体属四方晶系,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞棱边夹角均为 ,其晶胞结构如图。
,其晶胞结构如图。
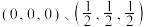 。则C点原子的分数坐标为
。则C点原子的分数坐标为②
 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
名校
解题方法
3 . A、B、C、D、E是原子序数依次增大的五种短周期元素,F为第四周期元素。请根据下列相关信息回答问题。
(1)C离子的核外电子的轨道表示式是___________ 。
(2)F位于元素周期表第___________ 族,属于___________ 区。
(3)A、E的最高价氧化物对应的水化物酸性更强的是___________ (填化学式)。
(4)B、C和E元素的电负性由大到小的顺序是___________ (填元素符号)。
(5)常温常压下A的氢化物极易溶于水,从微粒间相互作用的角度分析原因:___________ (写出两条)。
(6)从原子结构的角度解释元素D的第一电离能高于同周期相邻元素的原因:___________ 。
| 元素 | 相关信息 |
| A | 基态原子的p轨道处于半充满状态 |
| B | 原子核外s能级上的电子总数与p能级上的电子总数相等,第一电离能低于同周期相邻元素 |
| C | 在同周期元素中,原子半径最大、电负性最小 |
| D | 电离能/(kJ•mol-1)数据:I1=740;I2=1500;I3=7700;I4=10500…… |
| E | 其价电子中,在不同形状的原子轨道中运动的电子数相等 |
| F | 在周期表的第7纵列 |
(2)F位于元素周期表第
(3)A、E的最高价氧化物对应的水化物酸性更强的是
(4)B、C和E元素的电负性由大到小的顺序是
(5)常温常压下A的氢化物极易溶于水,从微粒间相互作用的角度分析原因:
(6)从原子结构的角度解释元素D的第一电离能高于同周期相邻元素的原因:
您最近一年使用:0次
名校
4 . 现有四种元素,其中两种元素基态原子的电子排布式如下:①1s22s22p63s23p2②1s22s22p63s23p3,另两种元素的价电子排布式为③2s22p3④2s22p4,则下列有关比较中正确的是
| A.原子半径:①>②>④>③ | B.第一电离能:④>③>②>① |
| C.电负性: ④>③>②>① | D.最高正化合价:④>③=②>① |
您最近一年使用:0次
2024-04-08更新
|
272次组卷
|
2卷引用:陕西省宝鸡市金台区2023-2024学年高二上学期期末检测化学试题
解题方法
5 . 回答下列问题:
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气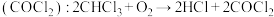 ,光气
,光气 分子的立体构型是
分子的立体构型是________ 形。
(2)某有机物的结构简式为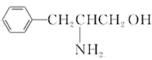 。该有机物分子是
。该有机物分子是____________ (填“极性”或“非极性”)分子,该有机物分子中采取 杂化的原子对应元素的电负性由大到小的顺序为
杂化的原子对应元素的电负性由大到小的顺序为____________ 。
(3)乙二胺 分子中氮原子杂化类型为
分子中氮原子杂化类型为_________________ 。
(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸( )是一种弱酸,其分子结构可表示为
)是一种弱酸,其分子结构可表示为 ,肼
,肼 被亚硝酸氧化时便可得到氢叠氮酸
被亚硝酸氧化时便可得到氢叠氮酸 ,发生的反应为
,发生的反应为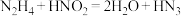 。
。 的酸性和醋酸相近,可微弱电离出
的酸性和醋酸相近,可微弱电离出 和
和 。
。
①叠氮酸根能与许多金属离子等形成配合物,如 ,根据价层电子对互斥理论判断
,根据价层电子对互斥理论判断 的空间构型为
的空间构型为________________ 。
②下列有关说法正确的是_____________ (填序号)。
A. 中含有5个
中含有5个 键
键
B. 中的三个氮原子均采用
中的三个氮原子均采用 杂化
杂化
C. 、
、 、
、 、
、 都是极性分子
都是极性分子
D.肼 的沸点高达
的沸点高达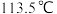 ,说明肼分子间可形成氢键
,说明肼分子间可形成氢键
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气
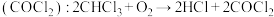 ,光气
,光气 分子的立体构型是
分子的立体构型是(2)某有机物的结构简式为
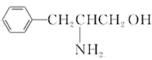 。该有机物分子是
。该有机物分子是 杂化的原子对应元素的电负性由大到小的顺序为
杂化的原子对应元素的电负性由大到小的顺序为(3)乙二胺
 分子中氮原子杂化类型为
分子中氮原子杂化类型为(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸(
 )是一种弱酸,其分子结构可表示为
)是一种弱酸,其分子结构可表示为 ,肼
,肼 被亚硝酸氧化时便可得到氢叠氮酸
被亚硝酸氧化时便可得到氢叠氮酸 ,发生的反应为
,发生的反应为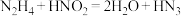 。
。 的酸性和醋酸相近,可微弱电离出
的酸性和醋酸相近,可微弱电离出 和
和 。
。①叠氮酸根能与许多金属离子等形成配合物,如
 ,根据价层电子对互斥理论判断
,根据价层电子对互斥理论判断 的空间构型为
的空间构型为②下列有关说法正确的是
A.
 中含有5个
中含有5个 键
键B.
 中的三个氮原子均采用
中的三个氮原子均采用 杂化
杂化C.
 、
、 、
、 、
、 都是极性分子
都是极性分子D.肼
 的沸点高达
的沸点高达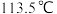 ,说明肼分子间可形成氢键
,说明肼分子间可形成氢键
您最近一年使用:0次
解题方法
6 . 下列关于元素的说法正确的是
| A.基态原子失去一个电子转化为基态正离子所需要的能量叫做第一电离能 |
| B.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 |
| C.金属的电负性小于1.8,而非金属的电负性大于1.8 |
| D.元素的电负性越大,非金属性就越强,元素原子的第一电离就越大 |
您最近一年使用:0次
解题方法
7 . 四种短周期元素X、Y、Z、W的原子序数依次增大,其结构信息如表所示。
下列说法中正确的是
| 元素 | 结构信息 |
| X | 基态原子核外s能级的电子数等于p能级的电子数 |
| Y | 基态原子的M能层只有1种自旋电子 |
| Z | 在元素周期表中,族序数等于周期数 |
| W | 基态原子核外p能级只有1个未成对电子 |
A.X的价层电子排布式为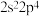 |
B.电负性: |
C.离子半径: |
D.工业上通过电解熔融 得到Z单质 得到Z单质 |
您最近一年使用:0次
8 . X、Y、Z、Q、R是元素周期表前四周期元素,且原子序数依次增大;X原子核外有6种不同运动状态的电子;Y原子的最外层电子数比次外层电子数多3个;基态Z原子的 能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是
能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是
 能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是
能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是A.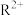 的价电子排布式为 的价电子排布式为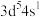 | B.电负性:X>Y>Z |
| C.最简单氢化物的稳定性:Y>Q | D.X的氢化物中只含有σ键 |
您最近一年使用:0次
解题方法
9 . 1869年门捷列夫编排的元素周期表为我们学习化学提供了理论依据。H、Li、Na、K位于周期表中ⅠA族。下列说法正确的是
| A.元素周期表的每个周期都是从ns能级开始,以mp能级结束 |
B.电负性大小: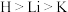 |
C.第一电离能: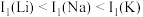 |
D.碱性强弱: |
您最近一年使用:0次
10 . 下列物质的结构或性质及其解释均正确的是
| 选项 | 物质的结构或性质 | 解释 |
| A | 极性: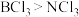 | B元素和Cl元素的电负性差值大于N元素和Cl元素的电负性差值 |
| B | 沸点:对羟基苯甲醛>邻羟基苯甲醛 | 对羟基苯甲醇分子间范德华力更强 |
| C |  在水中的溶解度比在 在水中的溶解度比在 中的溶解度更大 中的溶解度更大 |  是弱极性分子 是弱极性分子 |
| D | 电子云半径3s>1s | 3s电子能量高,在离核更远的区域出现的概率大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



