23-24高三下·陕西西安·阶段练习
解题方法
1 . CdS、ZnS等硫化物与TiO2、SnO2、ZnO等进行复合,可以得到性能很好的复合半导体光催化剂。回答下列问题:
(1)Sn与C同主族,基态Sn原子的价层电子排布式为_______ ,基态Ti原子核外电子有_______ 种空间运动状态, 核外未成对电子数为
核外未成对电子数为_______ ,ZnS、ZnO中各元素的电负性由大到小的顺序为_______ 。
(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。_______ ;图2中N原子会和B原子形成配位键,成键时_______ (填元素符号)原子提供空轨道。
(3)N、O、F三种元素的第一电离能由大到小的顺序为_______ (填元素符号),解释其原因:_______ 。
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。_______ 。
②若晶胞参数为anm,该晶体的密度为_______ g (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Sn与C同主族,基态Sn原子的价层电子排布式为
 核外未成对电子数为
核外未成对电子数为(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。

(3)N、O、F三种元素的第一电离能由大到小的顺序为
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是
 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。
②若晶胞参数为anm,该晶体的密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
2 . Fe、Co、Ni、Cu均为第四周期元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为___________ 。在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是___________ 。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有___________ 个;C、N、B的电负性由小到大的顺序为___________ 。
(3)基态 的核外电子排布式为
的核外电子排布式为___________ ; 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式___________ 、___________ 。
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为___________ ;该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、B点原子的分数坐标分别为 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为___________ ;晶胞中C、D间距离d=___________ pm。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为
 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有(3)基态
 的核外电子排布式为
的核外电子排布式为 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为
您最近一年使用:0次
3 . 镓 、铟
、铟 都是典型的稀有分散元素。回答下列问题:
都是典型的稀有分散元素。回答下列问题:
(1)基态 原子的核外价电子排布式为
原子的核外价电子排布式为_____ ,最高能级电子的电子云形状为_____ 。
(2)一种含镓药物的合成方法如图所示: 原子的杂化方式为
原子的杂化方式为_____ , 化合物
化合物 中含有的
中含有的 键的物质的量为
键的物质的量为_____ 。化合物Ⅰ中所含元素的电负性由大到小的顺序为_____ (用元素符号表示)。
②化合物Ⅱ中 的配位数为
的配位数为_____ ,
_____ 。
(3)一种由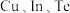 组成的晶体属四方晶系,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞棱边夹角均为 ,其晶胞结构如图。
,其晶胞结构如图。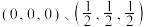 。则C点原子的分数坐标为
。则C点原子的分数坐标为_____ 。
② 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为_____ (用含 的代数式表示)
的代数式表示) 。
。
 、铟
、铟 都是典型的稀有分散元素。回答下列问题:
都是典型的稀有分散元素。回答下列问题:(1)基态
 原子的核外价电子排布式为
原子的核外价电子排布式为(2)一种含镓药物的合成方法如图所示:

 原子的杂化方式为
原子的杂化方式为 化合物
化合物 中含有的
中含有的 键的物质的量为
键的物质的量为②化合物Ⅱ中
 的配位数为
的配位数为
(3)一种由
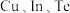 组成的晶体属四方晶系,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞棱边夹角均为 ,其晶胞结构如图。
,其晶胞结构如图。
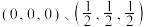 。则C点原子的分数坐标为
。则C点原子的分数坐标为②
 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
名校
4 . 下面关于四种短周期元素的原子比较正确的是
①基态原子的电子排布式: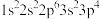 ;②3p轨道半充满的原子;③原子核外有4种不同能量的电子,且只有一个单电子;④s能级电子总数等于p能级电子总数的p区原子
;②3p轨道半充满的原子;③原子核外有4种不同能量的电子,且只有一个单电子;④s能级电子总数等于p能级电子总数的p区原子
①基态原子的电子排布式:
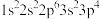 ;②3p轨道半充满的原子;③原子核外有4种不同能量的电子,且只有一个单电子;④s能级电子总数等于p能级电子总数的p区原子
;②3p轨道半充满的原子;③原子核外有4种不同能量的电子,且只有一个单电子;④s能级电子总数等于p能级电子总数的p区原子| A.最高正化合价:④=①>②>③ | B.原子半径:③>②>①>④ |
| C.电负性;③>②>①>④ | D.第一电离能:④>①>②>③。 |
您最近一年使用:0次
2024-04-11更新
|
196次组卷
|
2卷引用:陕西省西安市铁一中学2023-2024学年高二下学期第一次月考化学试题
名校
5 . 已知A、B、C、D、E是原子序数依次增大的前四周期元素,其元素性质或原子结构如表:
下列说法正确的是
| 元素 | 元素性质或原子结构 |
| A | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B | 原子最高能级的不同轨道都有电子,且自旋状态相同 |
| C | 所有元素中电负性最大的元素 |
| D | 位于周期表中第4纵列 |
| E | 基态原子M层全充满,最高能级的原子轨道半充满的主族元素 |
| A.最高价氧化物对应水化物的酸性强弱:C>B>A |
| B.B元素的原子核外电子有7种空间运动状态 |
| C.D元素基态原子的最高能层有4个电子 |
D.E的基态原子的简化电子排布式为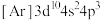 |
您最近一年使用:0次
名校
6 . 下列关于物质结构与性质的说法,不正确的是
A. 中的 中的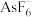 离子的空间结构为正八面体形 离子的空间结构为正八面体形 |
| B.C、H、O三种元素的电负性由小到大的顺序为H<C<O |
C.HClO、 、 、 的中心原子价层电子对数不完全相同 的中心原子价层电子对数不完全相同 |
| D.第四周期元素中,Ga的第一电离能低于Zn |
您最近一年使用:0次
名校
解题方法
7 . 铜是人类最早使用的金属之一,铜的使用对早期人类文明的进步影响深远。回答下列问题:
(1)基态Cu2+的价电子排布式为___________ 。
(2)已知铜的某种配合物A的结构如图所示:
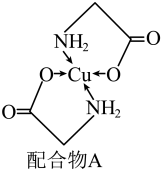
①A中所含的三种元素C、N、O的电负性由大到小的顺序为___________ 。
②配合物中氮原子的杂化轨道类型为___________ 。
③配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是___________ (填“极性”或“非极性”)分子。
(3)铜盐是自然界中重要的盐,CuSO4中SO 的立体构型为
的立体构型为___________ ;Cu(NO3)2中的化学键类型为___________ 。
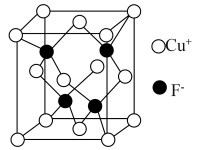
(4)CuF的晶胞结构如图所示。在CuF晶体中距离Cu+最近的F-有___________ 个。已知CuF的密度为7.1g/cm3,则CuF的晶胞参数a=___________ nm(列出计算式)。
(1)基态Cu2+的价电子排布式为
(2)已知铜的某种配合物A的结构如图所示:

①A中所含的三种元素C、N、O的电负性由大到小的顺序为
②配合物中氮原子的杂化轨道类型为
③配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是
(3)铜盐是自然界中重要的盐,CuSO4中SO
 的立体构型为
的立体构型为(4)CuF的晶胞结构如图所示。在CuF晶体中距离Cu+最近的F-有

您最近一年使用:0次
2023-12-31更新
|
144次组卷
|
2卷引用:2024届陕西省西安市第一中学高三上学期12月月考理综试卷
名校
解题方法
8 . 下列有关物质结构与性质的比较正确的是
A.分子的极性: | B.酸性: |
C.键角: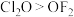 | D.基态原子未成对电子数:Mn>Cr |
您最近一年使用:0次
2023-12-16更新
|
598次组卷
|
5卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期末质量检化学试题
解题方法
9 . 食用碱是人们生活中常用的食品疏松剂和肉类嫩化剂,其成分为纯碱 和小苏打
和小苏打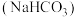 。下列说法正确的是
。下列说法正确的是
 和小苏打
和小苏打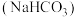 。下列说法正确的是
。下列说法正确的是A.离子半径: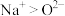 | B.电负性: |
C.非金属性: | D.第一电离能: |
您最近一年使用:0次
2023-12-01更新
|
553次组卷
|
5卷引用:陕西省西安市2023-2024学年高二上学期期末考试化学试题
名校
解题方法
10 . 下列说法不正确的是
| A.电负性:N> P>Li |
B.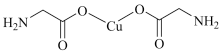 中σ键和 中σ键和 键比例为7:1 键比例为7:1 |
C.N2与 互为等电子体, 互为等电子体, 中含有的 中含有的 键数目为 键数目为 |
D.C 中的所有原子均共面 中的所有原子均共面 |
您最近一年使用:0次
2023-04-08更新
|
247次组卷
|
3卷引用:陕西省西安市西北工业大学附属中学2023-2024学年高二上学期期末质量检化学试题



