9-10高二下·江苏·期末
1 . 下列说法中不正确的是
A.乙烯、乙炔和氮分子中都既含有 键又含有 键又含有 键 键 |
| B.分子间作用力与氢键可同时存在于不同的分子之间 |
| C.金属元素和非金属元素的原子之间也能直接形成共价键 |
| D.NH3、H2O2、CCl4和苯分子中的共价键全部都是极性键 |
您最近半年使用:0次
9-10高二下·江苏·期末
解题方法
2 . 为比较温室效应气体对全球增温现象的影响,科学家以CO2为相对标准,引入了“温室效应指数”的概念(如下表)。

回答下列问题:
⑴6种气体中,温室效应指数最大的物质属于____ (选填“极性分子”或“非极性分子”)。
⑵在水分子中,O原子上的价层电子对数为______ 。
⑶N2O4分子结构式为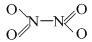 ,分子为平面结构。N2O4分子中N原子的杂化方式为
,分子为平面结构。N2O4分子中N原子的杂化方式为_____ ,在N2O4分子的结构式上,将你认为是配位键的共价键上加上箭头_____ 。
⑷O3具有吸收紫外光的功能。
①根据等电子原理,判断O3分子的空间构型为_____ 。
②紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:_____ 。

回答下列问题:
⑴6种气体中,温室效应指数最大的物质属于
⑵在水分子中,O原子上的价层电子对数为
⑶N2O4分子结构式为
 ,分子为平面结构。N2O4分子中N原子的杂化方式为
,分子为平面结构。N2O4分子中N原子的杂化方式为⑷O3具有吸收紫外光的功能。
①根据等电子原理,判断O3分子的空间构型为
②紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:
| 共价键 | C-C | C-N | C-S |
| 键能/ kJ·mol-1 | 347 | 305 | 259 |
您最近半年使用:0次
名校
3 . 下列分子中,所有原子都满足最外层为8电子结构的是
| A.BF3 | B.PCl5 | C.HCl | D.CF2Cl2 |
您最近半年使用:0次
2016-12-09更新
|
638次组卷
|
8卷引用:2015-2016学年江苏省宜兴市普通高中高二上学期期末化学试卷
2015-2016学年江苏省宜兴市普通高中高二上学期期末化学试卷(已下线)2009-2010学年黑龙江佳一中高二第三学段考试化学试卷(选修3)(已下线)2010—2011学年黑龙江大庆铁人中学高二下学期期中考试化学试卷(已下线)2012-2013学年宁夏银川一中高二下学期期末考试化学试卷2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷【全国百强校】山西省平遥中学校2018-2019学年高二下学期期中考试化学试题山西省实验中学2020届高三化学复习针对性试题集(三)(已下线)专题07 物质结构与元素周期律-备战2021届高考化学二轮复习题型专练
9-10高二下·吉林·期中
4 . 下列物质属于不等电子体的是
| A.CH4和NH4+ | B.B3H6N3和C6H6 |
| C.CO2、N2O | D.H2O和CH4 |
您最近半年使用:0次
2016-12-09更新
|
713次组卷
|
5卷引用:2011-2012学年江苏省泰州中学高二上学期期中考试化学(选修)试卷
(已下线)2011-2012学年江苏省泰州中学高二上学期期中考试化学(选修)试卷(已下线)2009一2010年度吉林一中下学期高二期中考试化学卷2015-2016学年吉林省辽源市田家炳高中高二下期中化学试卷2015-2016学年吉林省汪清六中高二下学期期末化学试卷山西省忻州市岢岚县中学2020-2021学年高二下学期4月月考化学试题
2010·江苏南通·一模
解题方法
5 . CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:

②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子: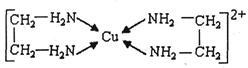
请回答下列问题:
(1)基态Cu原子的核外电子排布式为________________ ,H、N、O三种元素的电负性由大到小的顺序是____________ 。
(2)SO2分子的空间构型为________ ,与SnCl4互为等电子体的一种离子的化学式为____________ 。
(3)乙二胺分子中氮原子轨道的杂化类型为____________ ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是___________________________ 。
(4)②中所形成的配离子中含有的化学键类型有__________ 。(填字母)
A 配位键 B 极性键 C 离子键 D 非极性键

(5)CuCl的晶胞结构如上图所示,其中Cl原子的配位数为__________ 。
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:

②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:

请回答下列问题:
(1)基态Cu原子的核外电子排布式为
(2)SO2分子的空间构型为
(3)乙二胺分子中氮原子轨道的杂化类型为
(4)②中所形成的配离子中含有的化学键类型有
A 配位键 B 极性键 C 离子键 D 非极性键

(5)CuCl的晶胞结构如上图所示,其中Cl原子的配位数为
您最近半年使用:0次
名校
6 . 下列化学键中,键的极性最强的是( )
| A.C—F | B.C—O | C.C—N | D.C—C |
您最近半年使用:0次
2016-12-09更新
|
977次组卷
|
12卷引用:江苏省无锡市市北高级中学2023-2024学年高二上学期期末检测化学试卷
江苏省无锡市市北高级中学2023-2024学年高二上学期期末检测化学试卷(已下线)2010年福建师大附中高二第二学期化学模块测试卷《物质结构与性质》(已下线)2010—2011学年福建省罗源一中高二3月月考化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷四川省凉山木里中学2017-2018学年高二上学期期中考试化学试卷河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第二章 综合检测2贵州省普定县一中2018-2019学年高二上学期期中考试化学试题宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题新疆昌吉市教育共同体2019-2020学年高二下学期期中考试化学试题(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第1节 共价键模型苏教2020版选择性必修2专题3第四单元 分子间作用力 分子晶体课后习题宁夏银川市唐徕中学2022-2023学年高二下学期期中考试化学试题
真题
名校
7 . 生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式___ 。
(2)根据等电子原理,写出CO分子的结构式_________ 。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O 沉淀。
①甲醇的沸点比甲醛的高,其主要原因是____________________ ;
甲醛分子中碳原子轨道的杂化类型为_________ 。
②甲醛分子的空间构型是_________ ;
1mol甲醛分子中σ键的数目为_____ 。
③在1个Cu2O 晶胞中(结构如图所示),_______ 。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式
(2)根据等电子原理,写出CO分子的结构式
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O 沉淀。
①甲醇的沸点比甲醛的高,其主要原因是
甲醛分子中碳原子轨道的杂化类型为
②甲醛分子的空间构型是
1mol甲醛分子中σ键的数目为
③在1个Cu2O 晶胞中(结构如图所示),

您最近半年使用:0次
2016-12-09更新
|
681次组卷
|
5卷引用:2009年普通高等学校招生统一考试化学试题(江苏卷)
2009年普通高等学校招生统一考试化学试题(江苏卷)(已下线)2014年高二鲁科版选修3化学规范训练3.4几类其他聚集状态物质练习卷(已下线)2015届安徽省滁州中学高三九月份化学月考试卷河北省唐山市曹妃甸区第一中学2016-2017学年高二下学期期末考试化学试题河南省焦作市2022-2023学年第四中学高二下学期期中考试 化学试卷
8 . [物质结构]X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子。
请回答下列问题:
(1)Y基态原子的电子排布式是________________ ;
(2)Z所在周期中第一电离能最大的主族元素是_______ 。
(3)XY2—的立体构型是________ ;
(4)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是_____ 。
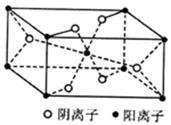
(5)将R单质的粉末加入X气态氢化物的浓溶液中,不断鼓入空气充分反应,得到深蓝色的[R(NH3)4](OH)2溶液,该反应的离子方程式是___________ ;1mol [R(NH3)4]2+中含有的σ键的数目是_______ 。
请回答下列问题:
(1)Y基态原子的电子排布式是
(2)Z所在周期中第一电离能最大的主族元素是
(3)XY2—的立体构型是
(4)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是

(5)将R单质的粉末加入X气态氢化物的浓溶液中,不断鼓入空气充分反应,得到深蓝色的[R(NH3)4](OH)2溶液,该反应的离子方程式是
您最近半年使用:0次
2013·江苏·一模
9 . CaC2可用于固氮:CaC2+N2 CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:______ 。
(2)C、N、O三种元素的第一电离能由小到大的顺序是______ 。
(3)NH3中N原子的杂化方式为______ ;根据价层电子对互斥理论推测CO 的空间构型为
的空间构型为______ 。
(4)CaCN2中阴离子为CN ,与CN
,与CN 互为等电子体的分子有
互为等电子体的分子有______ (填写一种化学式即可);写出CaCN2水解反应的化学方程式______ 。
 CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:
(2)C、N、O三种元素的第一电离能由小到大的顺序是
(3)NH3中N原子的杂化方式为
 的空间构型为
的空间构型为(4)CaCN2中阴离子为CN
 ,与CN
,与CN 互为等电子体的分子有
互为等电子体的分子有
您最近半年使用:0次
9-10高二下·江苏·期末
10 . 由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
(1)Cr2O3、CrCl3中Cr均为+3价,写出Cr3+的基态电子排布式______________ ;
(2)CCl4分子中C原子采取__________ 杂化成键。
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是_________ ,其中碳氧原子之间共价键是________ (填序号):
a.2个σ键b.2个π键c.1个σ键、1个π键
(4)CaO晶胞如右上图所示,CaO晶体中Ca2+的配位数为____ 。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3 401kJ•mol-1、NaCl-786kJ•mol-1。导致两者晶格能差异的主要原因是_________________________________ 。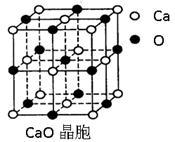
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
(1)Cr2O3、CrCl3中Cr均为+3价,写出Cr3+的基态电子排布式
(2)CCl4分子中C原子采取
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是
a.2个σ键b.2个π键c.1个σ键、1个π键
(4)CaO晶胞如右上图所示,CaO晶体中Ca2+的配位数为

您最近半年使用:0次



