13-14高三·江苏南通·阶段练习
1 . 已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如下图:

(1)Cu元素基态原子的外围电子排布式为_____ 。
(2)元素C、N、O的第一电离能由大到小排列顺序为__ 。
(3)配合物A中碳原子的轨道杂化类型为___ 。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有 键的数目为
键的数目为_____ 。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:__ (写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,

则该化合物的化学式是___ 。

(1)Cu元素基态原子的外围电子排布式为
(2)元素C、N、O的第一电离能由大到小排列顺序为
(3)配合物A中碳原子的轨道杂化类型为
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有
 键的数目为
键的数目为(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,

则该化合物的化学式是
您最近一年使用:0次
2016-12-09更新
|
334次组卷
|
6卷引用:2014届江苏省南通市高三第一次调研测试化学试卷
(已下线)2014届江苏省南通市高三第一次调研测试化学试卷(已下线)2015届江苏省苏州市高三9月学情调研化学试卷(已下线)2015届江苏省苏州市高三9月学情调研化学试卷江苏省东台市2017届高三5月模拟化学试题江苏省兴化市第一中学2016-2017学年高二下学期第三次月考化学试题2014-2015学年吉林省吉林市第一中学高二下期末化学试卷
2 . 下列各组粒子不属于等电子体的是
| A.O3和NO2 | B.CH4和NH4+ | C.N2O和CO2 | D.PCl3和SO32− |
您最近一年使用:0次
2016-12-09更新
|
138次组卷
|
2卷引用:2014-2015江苏省泰州市姜堰区高二下学期期中考试化学试卷
解题方法
3 . 氧化锌(ZnO)、氮化镓(GaN)及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气。

(1)Zn2+基态核外电子排布式为________ 。
(2)与水分子互为等电子体的一种阴离子是________ (填化学式)。
(3)氮化镓(GaN)的晶体结构如图1所示,其中氮原子的杂化轨道类型是________ ;N、Ga原子之间存在配位键,该配位键中提供电子对的原子是________ 。
(4)ZnO是两性氧化物,能跟强碱溶液反应生成[Zn(OH)4]2-。 不考虑空间构型,[Zn(OH)4]2-的结构可用示意图表示为________ 。
(5)某种ZnO晶体的晶胞如图2所示,与O2-距离最近的Zn2+有________ 个。

(1)Zn2+基态核外电子排布式为
(2)与水分子互为等电子体的一种阴离子是
(3)氮化镓(GaN)的晶体结构如图1所示,其中氮原子的杂化轨道类型是
(4)ZnO是两性氧化物,能跟强碱溶液反应生成[Zn(OH)4]2-。 不考虑空间构型,[Zn(OH)4]2-的结构可用示意图表示为
(5)某种ZnO晶体的晶胞如图2所示,与O2-距离最近的Zn2+有
您最近一年使用:0次
4 . 下列反应曾用于检测司机是否酒后驾驶:2Cr2O72-+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
(1)Cr3+基态核外电子排布式为_________ ;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是________ (填元素符号)。
(2)CH3COOH中C原子轨道杂化类型为______________ ;1molCH3COOH分子中含有σ键的数目为 ______ 。
(3)与H2O互为等电子体的一种阳离子为________ (填化学式);H2O与CH3CH3OH可以任意比例互溶,除因为它们都是极性分子外,还因为___________ 。
(1)Cr3+基态核外电子排布式为
(2)CH3COOH中C原子轨道杂化类型为
(3)与H2O互为等电子体的一种阳离子为
您最近一年使用:0次
2016-12-09更新
|
1528次组卷
|
4卷引用:2015年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)
2015年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)2016届江苏省东海县石榴高级中学高三上学期第一次月考化学试卷【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章02练基础
名校
解题方法
5 . 我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
请回答下列问题:(用A、B、C、D、E所对应的元素符号作答)
(1)B、C、D第一电离能由大到小为______________________ 。
(2)E的二价离子的电子排布式为________________________ 。
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为________ ;1 mol A2B2D4分子中含有σ键数目为________ 。
(4)与化合物BD互为等电子体的阴离子化学式为________ 等。
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是_______________ 。
(6)BD2在高温高压下所形成晶体的晶胞如图所示,一个该晶胞中含________ 个D原子。

| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
| C | 最外层P轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
(1)B、C、D第一电离能由大到小为
(2)E的二价离子的电子排布式为
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为
(4)与化合物BD互为等电子体的阴离子化学式为
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是
(6)BD2在高温高压下所形成晶体的晶胞如图所示,一个该晶胞中含

您最近一年使用:0次
2016-12-09更新
|
745次组卷
|
7卷引用:2015届江苏省泰州市高三第二次模拟考试化学试卷
2015届江苏省泰州市高三第二次模拟考试化学试卷2016届江苏省扬州中学高三上学期开学考试化学试卷西藏自治区拉萨中学2018届高三上学期第三次月考理综化学试题(已下线)二轮复习 专题17 物质结构与性质 押题专练步步为赢 高二化学暑假作业:作业十四 物质结构与性质(选修3)西藏自治区日喀则市2020届高三上学期学业水平测试(模拟)理综化学试题(已下线)易错点15 化学键-备战2023年高考化学考试易错题
解题方法
6 . 利用工业废铁粉(主要成为Fe3O4、Fe)与硫酸反应可制备硫酸盐。
(1)Fe2+基态核外电子排布式为________ 。
(2)FeSO4隔绝空气受热分解生成SO2、SO3、Fe2O3。SO2分子的空间构型为__________ ,其中S原子的杂化类型为________ 。与SO3互为等电子体的离子与分子分别为________ 、________ (填化学式)。
(3)苯酚可以与Fe3+发生显色反应。1 mol苯酚中含有σ键的数目为________ 。
(4)Fe3O4具有反尖晶石结构。某化合物MgxAlyOz与反尖晶石结构相仿,其结构如下图所示,它是由下列A、B方块组成。该化合物的化学式为________ 。
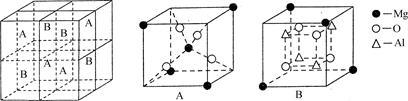
(1)Fe2+基态核外电子排布式为
(2)FeSO4隔绝空气受热分解生成SO2、SO3、Fe2O3。SO2分子的空间构型为
(3)苯酚可以与Fe3+发生显色反应。1 mol苯酚中含有σ键的数目为
(4)Fe3O4具有反尖晶石结构。某化合物MgxAlyOz与反尖晶石结构相仿,其结构如下图所示,它是由下列A、B方块组成。该化合物的化学式为

您最近一年使用:0次
7 . 尿素(H2NCONH2)是一种农业生产中常用的氮肥。在工业上,尿素还用于制造有机铁肥,如[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]。
(1)基态Fe3+的核外电子排布式为_______ 。
(2)C、N、O三种元素的第一电离能由小到大的顺序是_______ 。
(3)六氰合亚铁离子(Fe(CN) )中的配体CN-中C原子的杂化轨道类型是
)中的配体CN-中C原子的杂化轨道类型是_______ ,写出一种与CN-互为等电子体的单质分子的结构式_______ 。
(4)在一定条件下,NH3与CO2能合成尿素,1 mol尿素分子中,σ键的数目为_______ 。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为_______ 。

(1)基态Fe3+的核外电子排布式为
(2)C、N、O三种元素的第一电离能由小到大的顺序是
(3)六氰合亚铁离子(Fe(CN)
 )中的配体CN-中C原子的杂化轨道类型是
)中的配体CN-中C原子的杂化轨道类型是(4)在一定条件下,NH3与CO2能合成尿素,1 mol尿素分子中,σ键的数目为
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为

您最近一年使用:0次
2016-12-09更新
|
337次组卷
|
2卷引用:2015届江苏省无锡市高三期末考试化学试卷
8 . 三氟化硼二甲醚配合物是一种有机催化剂。下列相关构成微粒的表示不正确的是
| A.二甲醚的结构简式:C2H6O |
B.中子数为5的硼原子: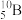 |
C.氟原子结构示意图: |
D.三氟化硼的电子式: |
您最近一年使用:0次
2016-12-09更新
|
472次组卷
|
2卷引用:2015届江苏省南京市、盐城市高三一模化学试卷
9 . 本题包括A、B两小题,请选定其中一题,并在相应的答题区域内作答。若多做,则按A题评分。
A.《物质结构与性质》非血红素铁是食物中的铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物。
(1)Fe2+基态核外电子排布式为______________ 。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为________ (填化学式)。
(3)蛋白质分子中氨基氮原子的轨道杂化类型是___ ;1mol 乙酸分子中含有σ的键的数目为_____ 。
(4)把氯气通入黄血盐(K4[Fe(CN)6])溶液中,得到赤血盐(K3[Fe(CN)6]),写 出该变化的化学方程式_______________________ 。
(5)FeO晶胞结构如图所示,FeO晶体中Fe2+配位数为____ 。

A.《物质结构与性质》非血红素铁是食物中的铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物。
(1)Fe2+基态核外电子排布式为
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为
(3)蛋白质分子中氨基氮原子的轨道杂化类型是
(4)把氯气通入黄血盐(K4[Fe(CN)6])溶液中,得到赤血盐(K3[Fe(CN)6]),写 出该变化的化学方程式
(5)FeO晶胞结构如图所示,FeO晶体中Fe2+配位数为

您最近一年使用:0次
10 . 在工农业生产中锌,铜等金属有着广泛的应用。
(1)请写出锌元素的基态原子核外电子排布式______________ 。
(2)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-=CH3COO-),其反应是: [Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3]Ac•CO[醋酸羰基三氨合铜(I)]
[Cu(NH3)3]Ac•CO[醋酸羰基三氨合铜(I)]
①C、N、O三种元素的第一电离能由小到大的顺序为______________ 。
②羰基中碳原子的轨道杂化方式是______________ ,1mol乙酸分子中含有σ键的数目为______________
③与CO互为等电子体的一种阴离子是______________ 。
(3)如图是铜的一种氯化物晶体的晶胞结构,该晶胞中每个铜原子周围距离最近的氯原子数目为______________ 。

(1)请写出锌元素的基态原子核外电子排布式
(2)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-=CH3COO-),其反应是: [Cu(NH3)2]Ac+CO+NH3
 [Cu(NH3)3]Ac•CO[醋酸羰基三氨合铜(I)]
[Cu(NH3)3]Ac•CO[醋酸羰基三氨合铜(I)]①C、N、O三种元素的第一电离能由小到大的顺序为
②羰基中碳原子的轨道杂化方式是
③与CO互为等电子体的一种阴离子是
(3)如图是铜的一种氯化物晶体的晶胞结构,该晶胞中每个铜原子周围距离最近的氯原子数目为

您最近一年使用:0次



