名校
解题方法
1 . 下列关于 、
、 、
、 三种微粒的说法不正确的是
三种微粒的说法不正确的是
 、
、 、
、 三种微粒的说法不正确的是
三种微粒的说法不正确的是| A.三种微粒所含有的电子数相等 |
| B.三种微粒中氮原子的杂化方式相同 |
| C.三种微粒的空间构型相同 |
D.键角大小关系:NH >NH3>NH >NH3>NH |
您最近一年使用:0次
2023-06-24更新
|
570次组卷
|
22卷引用:2015-2016学年黑龙江省哈尔滨九中高二下期末化学试卷
2015-2016学年黑龙江省哈尔滨九中高二下期末化学试卷云南省凤庆县第一中学2021-2022学年高二下学期3月份考试化学试题四川省成都市蒲江县蒲江中学2020-2021学年高二3月月考化学试题陕西省宝鸡市金台区2020-2021学年高二下学期期中考试化学试题新疆新源县第二中学2020-2021学年高二下学期期末联考化学试题(已下线)2.2.2 杂化轨道理论简介-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)2.2.3 分子的空间结构及中心原子杂化轨道类型的判断方法-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)专题4 分子空间结构与物质性质 本专题复习提升专题强化练4 微粒的空间结构黑龙江省哈尔滨市宾县第二中学2021-2022学年高二下学期期末考试化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章02练基础(已下线)【知识图鉴】单元讲练测选择性必修2第二章01讲核心辽宁省部分重点中学2022-2023学年高二上学期期末联考化学试题辽宁省鞍山市普通高中2022-2023学年高二下学期第一次月考化学(A卷)试题山东省泰安市2022-2023学年高二下学期4月期中考试化学试题四川省广元中学2022-2023学年高二下学期4月月考化学试题安徽省安庆市第二中学2022-2023学年高二下学期期中考试化学试题陕西师范大学附属中学2022-2023学年高二下学期期末考试化学试题辽宁省丹东市第二中学 大石桥市第三高级中学2022-2023学年高二上学期期末联考化学试题广东省东莞实验中学2022-2023学年高二上学期第一次月考化学试题北京师范大学附属中学2023-2024学年高二上学期期末考试化学试卷(已下线)热点04 分子的空间结构
10-11高二下·福建·期中
名校
2 . 下列说法中不正确的是
A. 键比 键比 键重叠程度大,形成的共价键通常更牢固 键重叠程度大,形成的共价键通常更牢固 |
B.两个原子之间形成共价键时,最多有一个 键 键 |
C.气体单质中,一定有 键,可能有 键,可能有 键 键 |
D. 分子中有一个 分子中有一个 键,2个 键,2个 键 键 |
您最近一年使用:0次
2023-04-08更新
|
239次组卷
|
87卷引用:云南省香格里拉县一中2018-2019学年高二上学期期中考试化学试题
云南省香格里拉县一中2018-2019学年高二上学期期中考试化学试题云南省普洱市景东县第一中学2018-2019学年高二上学期期末考试化学试题云南省玉溪市江川区第二中学2018-2019学年高二上学期期末考试化学试题云南省通海三中2018-2019学年高二下学期6月份考试化学试题云南省丘北县第二中学2018-2019学年高二下学期6月份考试化学试题云南省玉溪市新平三中2019-2020学年高二上学期12月份月考化学试题云南省丽江市永胜县第二中学2019—2020学年高二上学期期末考试化学试题(已下线)2010-2011学年福建省师大附中高二下学期期中考试化学试卷(已下线)2011-2012学年新疆农七师高级中学高二下学期期末考试试化学试卷(已下线)2012-2013学年福建三明泰宁一中高二下第一次阶段考试化学试卷(已下线)2012-2013学年辽宁葫芦岛第一高级中学高二下学期期中考试化学试卷(已下线)2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷(已下线)2012-2013学年湖北省荆州市监利县柘木中学高二下第二次月考化学卷2015-2016学年河北省邢台一中高二上12月月考化学试卷2015-2016学年四川省成都市新都一中高二下4月月考化学试卷福建省福州市八县(市)协作校2016-2017学年高二下学期期中考试化学试题福建省晋江市季延中学2017-2018学年高二上学期期中考试(理)化学试题高中化学人教版 选修三 第2章 分子结构与性质 共价键宁夏吴忠市高二人教版选修3第2章 分子结构与性质综合练习2河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.1 第1课时黑龙江省齐齐哈尔市第八中学2017-2018学年高二3月月考化学试题贵州省普定县一中2018-2019学年高二上学期期中考试化学试题贵州省习水县一中2018-2019学年高二上学期12月份月考化学试题贵州省毕节市黔西县第一中学2018-2019学年高二上学期12月份考试化学试题【全国百强校】河北省衡水市武邑中学2018-2019学年高二12月月考化学试题【全国百强校】山西省实验中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】内蒙古自治区赤峰市第二中学2018-2019学年高二下学期4月月考化学试题河北省唐山市开滦第二中学2018-2019学年高二下学期期中考试化学试题福建省泉州市泉港区第一中学2018-2019学年高二下学期第二次月考化学试题广西蒙山县第一中学2017-2018学年高二下学期期末考试化学试题吉林省汪清县第六中学2018-2019学年高二6月月考化学试题新疆乌鲁木齐市第四中学2018-2019学年高二下学期期末考试化学试题广西壮族自治区蒙山县第一中学2019-2020学年高二下学期期末考试化学试题广西蒙山一中2018-2019学年高二下学期期末考试化学试题(已下线)专题11.2 分子结构与性质(讲)-《2020年高考一轮复习讲练测》江苏省徐州一中2019-2020学年高二上学期期末调研测试化学试题河南省洛阳市2019-2020学年高二上学期期末考试化学试题贵州省岑巩县第二中学2019-2020学年高二上学期期末考试化学试题宁夏回族自治区吴忠市吴忠中学2020年高二化学人教版选修3《物质结构与性质》综合测试山东省枣庄市第三中学2019-2020学年高二下学期3月网上测试化学试题河北省正定中学2019-2020学年高二3月线上月考化学试题湖北省武汉市武昌区水果湖高中 2019-2020 学年高二下学期期中考试化学试题陕西省宝鸡市渭滨区2018-2019学年高二下学期期末考试化学试题吉林省长春市第二十九中学2019-2020学年高二下学期线上检测化学试题山东省泰安市2020年高二下学期化学期中考试(鲁科版)山西省太原市阳曲县第一中学2019-2020学年高二5月复学检测化学试题河北省沧州市任丘市第一中学2019-2020学年高二6月月考化学试题江苏省东台创新高级中学2019-2020学年高二下学期4月份月检测化学试题新疆生产建设兵团第四师第一中学2019-2020学年高二下学期期中考试化学试题(已下线)练习19 共价键-2020-2021学年【补习教材·寒假作业】高二化学(人教版)黑龙江省哈尔滨市第三十二中学2019-2020学年高二下学期期中考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第一节 共价键 第1课时 共价键鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第1节 共价键模型 第1课时 共价键的形成(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第1节 共价键模型高二选择性必修2(人教版2019)第二章 分子结构与性质 第一节综合训练(已下线)第2章 微粒间相互作用与物质性质(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)(已下线)模块同步卷11 综合检测卷(基础卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)(已下线)2.1 共价键(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)吉林省长春市第二十九中学2020-2021学年高二下学期第一学程考试化学试题新疆维吾尔自治区乌鲁木齐市第四中学2020-2021学年高二年级下学期期中考试化学试题黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高二下学期4月份月考化学试题甘肃省兰州市第一中学2020-2021学年高二下学期期中考试化学试题吉林省辽源市田家炳高级中学2020-2021学年高二下学期期中化学试题黑龙江省齐齐哈尔市第八中学校2020-2021学年高二下学期期中考试化学试题江苏省南通市如皋中学2020-2021学年高一下学期第二次阶段考试化学试题吉林省乾安县第七中学2020-2021学年高二下学期第六次质量检测化学试题福建省仙游县枫亭中学2020-2021学年高二下学期期中考试化学试题辽宁省鞍山市2020-2021学年高二下学期期末考试化学试题江西省九江市柴桑区第一中学2020-2021学年高二下学期5月月考化学试题(已下线)课时55 分子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)天津市蓟州区燕山中学2021-2022学年高三上学期第一次月考化学试题(已下线)2.1.1 共价键的类型-σ键和π键-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)2.1.1 共价键的类型——σ键和π键(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)新疆乌鲁木齐市第四中学2021-2022学年高二下学期期中考试化学试题浙江省台州市三门启超中学等两校2021-2022学年高二下学期期中联考化学试题海南省儋州川绵中学2021-2022学年高二下学期期中考试化学试题内蒙古赤峰二中2021-2022学年高二下学期第二次月考化学试题专题3 微粒间作用力与物质性质 第三单元 共价键共价晶体 第1课时 共价键的形成及类型湖南省长沙市长郡梅溪湖中学2021-2022学年高二下学期入学考试化学试题贵州省凯里学院附属中学2021-2022学年高二下学期3月月考化学试题新疆乌鲁木齐市第101中学2021-2022学年高二下学期期末考试化学试题吉林省吉林市田家炳高级中学2022-2023学年高二上学期期末线上考试化学试题湖北省十堰市普通高中协作体2022-2023学年高二下学期3月月考化学试题广东省惠州市博罗县博师高级中学2022-2023学年高二下学期3月考试化学试题宁夏青铜峡市宁朔中学2022-2023学年高二下学期期中考试化学试题3.3.1共价键的形成和类型 课中湖北省武汉西藏中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
3 . 下列关于σ 键和π键的说法不正确的是
| A.σ 键能单独形成,π键不能单独形成 |
| B.σ 键可以绕键轴旋转,π键不能绕键轴旋转 |
| C.双键中一定有一个σ 键,一个π键,三键中一定有一个σ 键,两个π键 |
| D.CH3-CH3、CH2=CH2、CH≡CH中的σ 键都是C-C键,所以键能都相同 |
您最近一年使用:0次
2022-09-15更新
|
546次组卷
|
6卷引用:江苏宿迁泗阳县众兴中学2021届高三上学期调研考试化学试题
11-12高二下·云南玉溪·期末
4 . PH3是一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是
| A.PH3分子呈三角锥形 |
| B.PH3分子是极性分子 |
| C.PH3沸点低于NH3沸点,因为P-H键键能低 |
| D.PH3分子稳定性低于NH3分子,因为N-H键键能高 |
您最近一年使用:0次
2021-04-21更新
|
2189次组卷
|
45卷引用:2011-2012学年云南省玉溪一中高二下学期期末考试化学试卷
(已下线)2011-2012学年云南省玉溪一中高二下学期期末考试化学试卷云南省元阳县第三中学2019-2020学年高二上学期期末考试化学试题(已下线)2012-2013学年福建省师大附中高二下学期期末考试化学试卷(已下线)2014高考化学名师知识点精编 选修3物质结构与性质练习卷2014-2015黑龙江省哈尔滨六中高二上期末化学试卷2014-2015学年浙江省台州中学高二下第一次统练化学试卷2015-2016学年湖北沙市中学高二下第一次半月考化学试卷2015-2016学年山西省太原五中高二下3月周练化学试卷2015-2016学年山西大学附中高二5月模块诊断化学试卷2015-2016学年贵州省思南中学高二下学期期末化学卷河北省蠡县中学2016-2017学年高二6月月考化学试题河北省廊坊市第一中学2016-2017学年高二下学期6月月考化学试题福建省莆田第六中学2017-2018学年高二6月月考化学试题B贵州省织金县一中2018-2019学年高二上学期12月份考试化学试题【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题【全国百强校】湖北省沙市中学2018-2019学年高二下学期期中考试化学试题新疆维吾尔自治区北京大学附属中学新疆分校2018-2019学年高二下学期期中考试化学试题西藏拉萨市八校2018-2019学年高二下学期期末联考化学试题河北省邢台市第二中学2018-2019学年高二下学期第四次月考化学试题上海市同济中学2016届高三上学期期中考试化学试题2020届高考化学二轮复习物质结构与性质专题练习天津市静海区第一中学2020届高三3月统练化学试题2012年上海市高考化学试题上海市封浜高级中学2014-2015学年高三上学期期中考试化学试题山西省运城市永济涑北中学2019-2020学年高二下学期3月月考化学试题第2章 化学键与分子间作用力 易错疑难集训(三)——A学习区 夯实基础(鲁科版选修3)河北省新乐市第一中学2018--2019学年高二下学期第二次月考化学试题湖北省利川市第五中学2019年-2020学年高二下学期期末考试化学试题上海市上海中学2016—2017学年高一上学期期末考试化学试题甘肃省兰州市第一中学2020-2021学年高二下学期4月月考化学试题黑龙江省哈尔滨市阿城区龙涤中学2020-2021学年高二4月月考化学试题湖北省十堰市2021届高三下学期4月调研考试化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期期中考试化学试题福建省连城一中2020-2021学年高二下学期第二次月考化学试题(已下线)第十二章能力提升检测卷(精练)-2022年一轮复习讲练测2021年海南高考化学试题变式题1-10广东省江门市新会陈经纶中学2021-2022学年高二下学期期中考试化学试题上海市南洋模范中学2022届高三等级考模拟训练七化学试题新疆精河县高级中学2021-2022学年高二下学期期中考试化学试题河南省鄢陵县第一高级中学2021-2022学年高二下学期第三次考试化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章02练基础山东省平邑县第一中学2022-2023学年高二下学期第一次月考化学试题广东省江门市开平市第二中学2021-2022学年高二下学期第7次段考化学试题广东省深圳市观澜中学2022-2023学年高二下学期月考(物质结构)化学试题天津市第九十五中学益中学校2023-2024学年高二下学期第一次月考化学试卷
解题方法
5 . 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、钴、硼、镓、硒等。已知铜的配合物A结构如图。请回答下列问题:

(1)基态二价铜离子的电子排布式为___ ,已知高温下Cu2O比CuO更稳定,试从核外电子排布角度解释___ 。
(2)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比是___ ;N2O与CO2互为等电子体,则N2O的电子式为___ 。
(3)铜与(SCN)2反应生成Cu(SCN)2,lmol(SCN)2中含有π键的数目为___ (用NA表示),HSCN结构有两种,硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N≡C≡S)的原因是___ 。
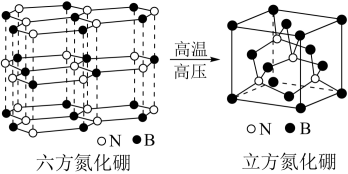
(4)立方氮化硼如图与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为___ 。
(5)六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为___ 。六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构、硬度与金刚石相似,其晶胞如图,晶胞边长为361.5pm,立方氮化硼的密度是___ g·cm-3(只列算式,NA为阿伏加德罗常数的值)。

(1)基态二价铜离子的电子排布式为
(2)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比是
(3)铜与(SCN)2反应生成Cu(SCN)2,lmol(SCN)2中含有π键的数目为
(4)立方氮化硼如图与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为
(5)六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为

您最近一年使用:0次
2021-01-07更新
|
457次组卷
|
2卷引用:云南省玉溪市普通高中2021届高三上学期第一次教学质量检测化学试题
名校
解题方法
6 . 向含Fe2+的溶液中加入少量K3[Fe(CN)6]溶液,可生成蓝色沉淀(Turbull blue,滕氏蓝),这是鉴别Fe2+的灵敏反应。回答下列问题:
(1)基态Fe原子的电子排布式为__________________ 。
(2)K3[Fe(CN)6]中C原子的杂化方式为_______ ,C、N和同周期的O比较,第一电离能由小到大的顺序为________ , C、 N、O的最简单氢化物的沸点由低到高的顺序为________________ 。(用分子式表示)。
(3)写出两种与CN-互为等电子体的分子___________ 、____________ (填分子式)。
(4)经X射线衔射证明,滕氏蓝的立方晶胞结构由如图所示的8个小立方体构成,一个晶胞中有4个K+,占有4个互不相邻的小立方体的体心。滕氏蓝的化学式为[以最简整数比表示,其中铁用Fe(II)、Fe(III)表示]_______ , Fe3+的配位数为_________ 。

(5)若滕氏蓝晶体的密度为ρg∙cm-3,计算其晶胞参数a=_____ nm。(列出计算式,设NA为阿伏加德罗常数的值)。
(1)基态Fe原子的电子排布式为
(2)K3[Fe(CN)6]中C原子的杂化方式为
(3)写出两种与CN-互为等电子体的分子
(4)经X射线衔射证明,滕氏蓝的立方晶胞结构由如图所示的8个小立方体构成,一个晶胞中有4个K+,占有4个互不相邻的小立方体的体心。滕氏蓝的化学式为[以最简整数比表示,其中铁用Fe(II)、Fe(III)表示]

(5)若滕氏蓝晶体的密度为ρg∙cm-3,计算其晶胞参数a=
您最近一年使用:0次
名校
解题方法
7 . 钛和钛的化合物用途比较广泛。
I.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理如图所示。请根据该反应机理中所涉及的元素及其化合物,回答下列问题:

(1)氧原子核外电子的空间运动状态有__ 种,基态钛原子的价电子排布式为__ ,该基态原子最外层的电子电子云轮廓图为__ 。
(2)C、O和Ti电负性由大到小的顺序为__ 。
(3)与CO分子互为等电子体的分子和离子各写出1种,分别为__ 和___ (填化学式)。
(4)在一定条件下CO可与铁单质反应生成配位化合物——羰基铁Fe(CO)5,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断Fe(CO)5晶体类型为__ 。从电负性角度分析,Fe(CO)5中与Fe形成配位键的是__ (填“碳”或“氧”)原子。
(5)同主族化学性质相似,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是___ 。H4SiO4中Si的轨道杂化类型为__ 。
II.钙钛矿晶体为高温超导领域里的一种化合物,其结构如图所示,该结构是具有代表性的最小重复单位。
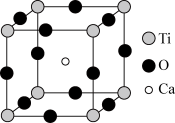
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有__ 个。
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为___ g/cm3。
I.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理如图所示。请根据该反应机理中所涉及的元素及其化合物,回答下列问题:

(1)氧原子核外电子的空间运动状态有
(2)C、O和Ti电负性由大到小的顺序为
(3)与CO分子互为等电子体的分子和离子各写出1种,分别为
(4)在一定条件下CO可与铁单质反应生成配位化合物——羰基铁Fe(CO)5,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断Fe(CO)5晶体类型为
(5)同主族化学性质相似,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是
II.钙钛矿晶体为高温超导领域里的一种化合物,其结构如图所示,该结构是具有代表性的最小重复单位。

(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为
您最近一年使用:0次
解题方法
8 . 氮及其化合物在工、农业生产中用途广泛。
(1)基态氮原子的核外电子排布式为__________ ;与N同周期的主族元素中,电负性大于N的有_______ 种。
(2)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与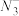 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:____________ ,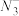 的空间构型为
的空间构型为_________ 。
(3)氮化硼(BN)和碳一样可以形成像石墨那样的平面六角形的层状结构,如图1所示,其中B原子的杂化方式为_______________ 。该氮化硼晶体具有良好的润滑性,其原因是___________________ 。

(4)一定条件下,层型BN可转变为立方氮化硼,其晶胞结构如图2所示。晶胞中B原子的配位数为_____________ ;已知晶体的密度为d g·cm-3,NA为阿伏加 德罗常数的值,则晶胞边长为__________ pm(用含d、NA的代数式表示)。
(1)基态氮原子的核外电子排布式为
(2)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与
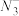 互为等电子体的分子的化学式:
互为等电子体的分子的化学式: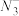 的空间构型为
的空间构型为(3)氮化硼(BN)和碳一样可以形成像石墨那样的平面六角形的层状结构,如图1所示,其中B原子的杂化方式为

(4)一定条件下,层型BN可转变为立方氮化硼,其晶胞结构如图2所示。晶胞中B原子的配位数为
您最近一年使用:0次
2020-09-25更新
|
421次组卷
|
3卷引用:云南、四川、贵州、西藏四省名校2021届高三第一次大联考化学试题
云南、四川、贵州、西藏四省名校2021届高三第一次大联考化学试题广西壮族自治区玉林市2021届高三上学期11月教学质量监测理科综合化学试题(已下线)第32讲 晶体结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)
9 . 亚铁氰化钾(K4[Fe(CN)6])是重要的化工原料和食品添加剂,又称黄血盐。黄血盐溶液与稀硫酸加热时发生反应:K4[Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:
(1)写出基态Fe2+的核外电子排布式______ 。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______ 和______ 。:1mol K4[Fe(CN)6]中含有σ键的数目为_____ NA。
(3)(NH4)2SO4中N原子的杂化方式为______ ;N和O相比,第一电离能更大的是______ ,电负性更大的是______ 。
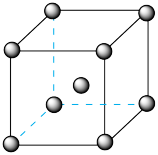
(4)铁、钾、钠均采用体心立方堆积,结构如图。晶胞中金属原子的配位数为______ ,钠、钾相比,熔点更高的是______ ,原因是______ 。已知铁的原子半径为r cm,阿伏加 德罗常数为NA,铁的相对原子质量为a,则铁的密度为______ g·cm-3。
 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:(1)写出基态Fe2+的核外电子排布式
(2)K4[Fe(CN)6]中的作用力除共价键外,还有
(3)(NH4)2SO4中N原子的杂化方式为
(4)铁、钾、钠均采用体心立方堆积,结构如图。晶胞中金属原子的配位数为

您最近一年使用:0次
19-20高一·全国·课时练习
名校
10 . 下列事实与氢键有关的是( )
| A.HF、HCl、HBr、HI的热稳定性依次减弱 |
| B.水加热到很高的温度都难以分解 |
| C.CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高 |
| D.氨气在水中的溶解度很大 |
您最近一年使用:0次
2020-08-14更新
|
78次组卷
|
3卷引用:5.2.2 共价键 分子间作用力练习(1)——《高中新教材同步备课》(苏教版 必修第一册)
(已下线)5.2.2 共价键 分子间作用力练习(1)——《高中新教材同步备课》(苏教版 必修第一册)云南省玉溪市民族中学2021-2022学年高一上学期期末考试化学试题安徽省合肥市第一中学2022-2023 学年高一下学期第三次素质拓展训练化学试题



