解题方法
1 . 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、钴、硼、镓、硒等。已知铜的配合物A结构如图。请回答下列问题:

(1)基态二价铜离子的电子排布式为___ ,已知高温下Cu2O比CuO更稳定,试从核外电子排布角度解释___ 。
(2)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比是___ ;N2O与CO2互为等电子体,则N2O的电子式为___ 。
(3)铜与(SCN)2反应生成Cu(SCN)2,lmol(SCN)2中含有π键的数目为___ (用NA表示),HSCN结构有两种,硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N≡C≡S)的原因是___ 。
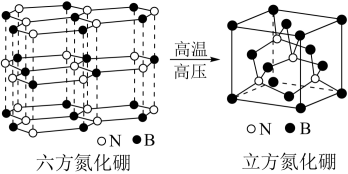
(4)立方氮化硼如图与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为___ 。
(5)六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为___ 。六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构、硬度与金刚石相似,其晶胞如图,晶胞边长为361.5pm,立方氮化硼的密度是___ g·cm-3(只列算式,NA为阿伏加德罗常数的值)。

(1)基态二价铜离子的电子排布式为
(2)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比是
(3)铜与(SCN)2反应生成Cu(SCN)2,lmol(SCN)2中含有π键的数目为
(4)立方氮化硼如图与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为
(5)六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为

您最近一年使用:0次
2021-01-07更新
|
457次组卷
|
2卷引用:云南省玉溪市普通高中2021届高三上学期第一次教学质量检测化学试题
名校
解题方法
2 . 向含Fe2+的溶液中加入少量K3[Fe(CN)6]溶液,可生成蓝色沉淀(Turbull blue,滕氏蓝),这是鉴别Fe2+的灵敏反应。回答下列问题:
(1)基态Fe原子的电子排布式为__________________ 。
(2)K3[Fe(CN)6]中C原子的杂化方式为_______ ,C、N和同周期的O比较,第一电离能由小到大的顺序为________ , C、 N、O的最简单氢化物的沸点由低到高的顺序为________________ 。(用分子式表示)。
(3)写出两种与CN-互为等电子体的分子___________ 、____________ (填分子式)。
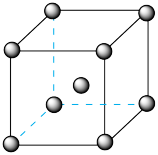
(4)经X射线衔射证明,滕氏蓝的立方晶胞结构由如图所示的8个小立方体构成,一个晶胞中有4个K+,占有4个互不相邻的小立方体的体心。滕氏蓝的化学式为[以最简整数比表示,其中铁用Fe(II)、Fe(III)表示]_______ , Fe3+的配位数为_________ 。

(5)若滕氏蓝晶体的密度为ρg∙cm-3,计算其晶胞参数a=_____ nm。(列出计算式,设NA为阿伏加德罗常数的值)。
(1)基态Fe原子的电子排布式为
(2)K3[Fe(CN)6]中C原子的杂化方式为
(3)写出两种与CN-互为等电子体的分子
(4)经X射线衔射证明,滕氏蓝的立方晶胞结构由如图所示的8个小立方体构成,一个晶胞中有4个K+,占有4个互不相邻的小立方体的体心。滕氏蓝的化学式为[以最简整数比表示,其中铁用Fe(II)、Fe(III)表示]

(5)若滕氏蓝晶体的密度为ρg∙cm-3,计算其晶胞参数a=
您最近一年使用:0次
名校
解题方法
3 . 钛和钛的化合物用途比较广泛。
I.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理如图所示。请根据该反应机理中所涉及的元素及其化合物,回答下列问题:

(1)氧原子核外电子的空间运动状态有__ 种,基态钛原子的价电子排布式为__ ,该基态原子最外层的电子电子云轮廓图为__ 。
(2)C、O和Ti电负性由大到小的顺序为__ 。
(3)与CO分子互为等电子体的分子和离子各写出1种,分别为__ 和___ (填化学式)。
(4)在一定条件下CO可与铁单质反应生成配位化合物——羰基铁Fe(CO)5,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断Fe(CO)5晶体类型为__ 。从电负性角度分析,Fe(CO)5中与Fe形成配位键的是__ (填“碳”或“氧”)原子。
(5)同主族化学性质相似,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是___ 。H4SiO4中Si的轨道杂化类型为__ 。
II.钙钛矿晶体为高温超导领域里的一种化合物,其结构如图所示,该结构是具有代表性的最小重复单位。
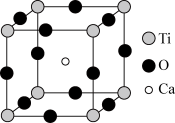
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有__ 个。
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为___ g/cm3。
I.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理如图所示。请根据该反应机理中所涉及的元素及其化合物,回答下列问题:

(1)氧原子核外电子的空间运动状态有
(2)C、O和Ti电负性由大到小的顺序为
(3)与CO分子互为等电子体的分子和离子各写出1种,分别为
(4)在一定条件下CO可与铁单质反应生成配位化合物——羰基铁Fe(CO)5,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断Fe(CO)5晶体类型为
(5)同主族化学性质相似,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是
II.钙钛矿晶体为高温超导领域里的一种化合物,其结构如图所示,该结构是具有代表性的最小重复单位。

(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为
您最近一年使用:0次
解题方法
4 . 氮及其化合物在工、农业生产中用途广泛。
(1)基态氮原子的核外电子排布式为__________ ;与N同周期的主族元素中,电负性大于N的有_______ 种。
(2)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与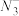 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:____________ ,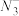 的空间构型为
的空间构型为_________ 。
(3)氮化硼(BN)和碳一样可以形成像石墨那样的平面六角形的层状结构,如图1所示,其中B原子的杂化方式为_______________ 。该氮化硼晶体具有良好的润滑性,其原因是___________________ 。

(4)一定条件下,层型BN可转变为立方氮化硼,其晶胞结构如图2所示。晶胞中B原子的配位数为_____________ ;已知晶体的密度为d g·cm-3,NA为阿伏加 德罗常数的值,则晶胞边长为__________ pm(用含d、NA的代数式表示)。
(1)基态氮原子的核外电子排布式为
(2)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与
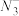 互为等电子体的分子的化学式:
互为等电子体的分子的化学式: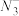 的空间构型为
的空间构型为(3)氮化硼(BN)和碳一样可以形成像石墨那样的平面六角形的层状结构,如图1所示,其中B原子的杂化方式为

(4)一定条件下,层型BN可转变为立方氮化硼,其晶胞结构如图2所示。晶胞中B原子的配位数为
您最近一年使用:0次
2020-09-25更新
|
421次组卷
|
3卷引用:云南、四川、贵州、西藏四省名校2021届高三第一次大联考化学试题
云南、四川、贵州、西藏四省名校2021届高三第一次大联考化学试题广西壮族自治区玉林市2021届高三上学期11月教学质量监测理科综合化学试题(已下线)第32讲 晶体结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)
5 . 亚铁氰化钾(K4[Fe(CN)6])是重要的化工原料和食品添加剂,又称黄血盐。黄血盐溶液与稀硫酸加热时发生反应:K4[Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:
(1)写出基态Fe2+的核外电子排布式______ 。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______ 和______ 。:1mol K4[Fe(CN)6]中含有σ键的数目为_____ NA。
(3)(NH4)2SO4中N原子的杂化方式为______ ;N和O相比,第一电离能更大的是______ ,电负性更大的是______ 。
(4)铁、钾、钠均采用体心立方堆积,结构如图。晶胞中金属原子的配位数为______ ,钠、钾相比,熔点更高的是______ ,原因是______ 。已知铁的原子半径为r cm,阿伏加 德罗常数为NA,铁的相对原子质量为a,则铁的密度为______ g·cm-3。
 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:(1)写出基态Fe2+的核外电子排布式
(2)K4[Fe(CN)6]中的作用力除共价键外,还有
(3)(NH4)2SO4中N原子的杂化方式为
(4)铁、钾、钠均采用体心立方堆积,结构如图。晶胞中金属原子的配位数为

您最近一年使用:0次
名校
解题方法
6 . 目前我国研制的稀土催化剂催化转化汽车尾气示意图如图:

(1)Zr原子序数为40,价电子排布式为___ 。图1中属于非极性的气体分子是___ 。
(2)①氟化硼(BF3)是石油化工的重要催化剂。BF3中B-F比BF 中B—F的键长短,原因是
中B—F的键长短,原因是___ 。
②乙硼烷(B2H6)是用作火箭和导弹的高能燃料,氨硼烷(H3NBH3)是最具潜力的储氢材料之一。

B2H6的分子结构如图2所示,其中B原子的杂化方式为___ 。
③H3NBH3的相对分子质量与B2H6相差不大,但是H3NBH3的沸点却比B2H6高得多,原因是__ 。
④硼酸盐是重要的防火材料。图3是硼酸钠晶体中阴离子(含B、O、H三种元素)的结构,该晶体中含有的化学键有__ 。
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键
(3)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,[Ni(CO)4]的配体中配位原子是___ 。
(4)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图4所示,则与每个Sr2+紧邻的O2-有___ 个。
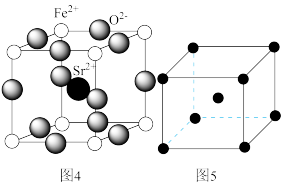
(5)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格(如图5所示),原子半径为apm,相对原子质量为b,阿伏加 德罗常数为NA,试计算晶体铌的密度为___ g·cm-3(用来a、b、NA表示计算结果)。

(1)Zr原子序数为40,价电子排布式为
(2)①氟化硼(BF3)是石油化工的重要催化剂。BF3中B-F比BF
 中B—F的键长短,原因是
中B—F的键长短,原因是②乙硼烷(B2H6)是用作火箭和导弹的高能燃料,氨硼烷(H3NBH3)是最具潜力的储氢材料之一。

B2H6的分子结构如图2所示,其中B原子的杂化方式为
③H3NBH3的相对分子质量与B2H6相差不大,但是H3NBH3的沸点却比B2H6高得多,原因是
④硼酸盐是重要的防火材料。图3是硼酸钠晶体中阴离子(含B、O、H三种元素)的结构,该晶体中含有的化学键有
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键
(3)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,[Ni(CO)4]的配体中配位原子是
(4)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图4所示,则与每个Sr2+紧邻的O2-有

(5)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格(如图5所示),原子半径为apm,相对原子质量为b,阿伏加 德罗常数为NA,试计算晶体铌的密度为
您最近一年使用:0次
2020-07-02更新
|
290次组卷
|
2卷引用:山东师范大学附属中学2020届普通高等学校招生全国统一考试化学试题(模拟一)
7 . 自然界中存在大量的元素,如钠、镁、铝、铁、铜、砷、锌、镍等在生活中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式________ ,砷属于________ 区元素。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
则A原子的价电子排布式为___________________________ 。
(3)锌化铜是一种金属互化物,其化学式有多种形式,如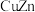 ,
,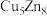 ,
, 等。其中所含元素铜的第二电离能
等。其中所含元素铜的第二电离能________ (填“大于”“小于”或“等于”)锌的第二电离能。
(4)用锌还原 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体 。该晶体所含元素中,电负性最大的元素是
。该晶体所含元素中,电负性最大的元素是________ ,与Ti形成配位键的配体是________ , 该配合物中含有
该配合物中含有 键的数目为
键的数目为________ 。
(5) 能形成多种配离子,如
能形成多种配离子,如 ,
, 等。
等。 的空间构型为:
的空间构型为:________ ;与 互为等电子体的分子有:
互为等电子体的分子有:___________________ (填分子式)。
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示 ,白色球表示
,白色球表示 ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=________  (用
(用 表示阿伏加 德罗常数)
表示阿伏加 德罗常数)
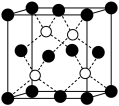
(1)请写出Fe的基态原子核外电子排布式
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能 |  |  | 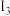 | 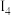 |
| A | 932 | 1821 | 15390 | 21771 |
则A原子的价电子排布式为
(3)锌化铜是一种金属互化物,其化学式有多种形式,如
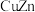 ,
,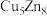 ,
, 等。其中所含元素铜的第二电离能
等。其中所含元素铜的第二电离能(4)用锌还原
 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体 。该晶体所含元素中,电负性最大的元素是
。该晶体所含元素中,电负性最大的元素是 该配合物中含有
该配合物中含有 键的数目为
键的数目为(5)
 能形成多种配离子,如
能形成多种配离子,如 ,
, 等。
等。 的空间构型为:
的空间构型为: 互为等电子体的分子有:
互为等电子体的分子有:(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示
 ,白色球表示
,白色球表示 ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ= (用
(用 表示阿伏加 德罗常数)
表示阿伏加 德罗常数)
您最近一年使用:0次
解题方法
8 . 硼及其化合物在耐高温合金工业、催化剂制造、高能燃料等方面有广泛应用。
(1)硼原子的价电子排布图为____________ 。
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为________ 。
(3)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的第一电离能:B__________ N(填“>”“<”或“=”,下同)。H2N―→BH2中B原子的杂化类型为________ 。
②Ti(BH4)3由TiCl3和LiBH4反应制得。BH4-的立体构型是________ ;写出制备反应的化学方程式:____________ 。
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。

①磷化硼晶体属于______________ 晶体(填晶体类型),____________ (填“是”或“否”)含有配位键。
②晶体中P原子的配位数为____________ 。
③已知BP的晶胞边长为a nm,NA为阿伏加 德罗常数的数值,则磷化硼晶体的密度为____________ g·cm-3(用含a、NA的式子表示)。
(1)硼原子的价电子排布图为
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为
(3)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的第一电离能:B
②Ti(BH4)3由TiCl3和LiBH4反应制得。BH4-的立体构型是
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。

①磷化硼晶体属于
②晶体中P原子的配位数为
③已知BP的晶胞边长为a nm,NA为阿伏加 德罗常数的数值,则磷化硼晶体的密度为
您最近一年使用:0次
名校
解题方法
9 . 硼(B)及其化合物在化学中具有十分重要的地位,请回答下列有关问题。
(1)基态硼原子中有_______ 种能量不同的电子,第一电离能介于B和N之间的第二周期元素有_______ 种。
(2)硼酸( )能够屏蔽核辐射,其晶体具有层状结构(每一层结构如图所示),成片状,有滑腻感,可作润滑剂。
)能够屏蔽核辐射,其晶体具有层状结构(每一层结构如图所示),成片状,有滑腻感,可作润滑剂。

①硼酸晶体内所含有作用力类型有__________________ ,根据硼酸的分子结构判断硼酸应属于________ (填“强酸”“中强酸”或“弱酸”),你的判断依据是_________________________ 。
②三氟化硼( )水解生成硼酸和氟硼酸(
)水解生成硼酸和氟硼酸( ),与
),与 互为等电子体的一种阴离子是
互为等电子体的一种阴离子是_________ (写化学式)。
(3)六方氮化硼的结构与石墨结构相类似(如图甲),上、下层平行,B、N原子相互交替,层内B—N核间距为acm,层间距为 ,晶体密度为
,晶体密度为 ,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为___________ ,其结构与石墨相似却不导电,原因是___________________ ,网状加德罗常数
________ 。(用含 的式子表示)。
的式子表示)。

(1)基态硼原子中有
(2)硼酸(
 )能够屏蔽核辐射,其晶体具有层状结构(每一层结构如图所示),成片状,有滑腻感,可作润滑剂。
)能够屏蔽核辐射,其晶体具有层状结构(每一层结构如图所示),成片状,有滑腻感,可作润滑剂。
①硼酸晶体内所含有作用力类型有
②三氟化硼(
 )水解生成硼酸和氟硼酸(
)水解生成硼酸和氟硼酸( ),与
),与 互为等电子体的一种阴离子是
互为等电子体的一种阴离子是(3)六方氮化硼的结构与石墨结构相类似(如图甲),上、下层平行,B、N原子相互交替,层内B—N核间距为acm,层间距为
 ,晶体密度为
,晶体密度为 ,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
 的式子表示)。
的式子表示)。
您最近一年使用:0次
解题方法
10 . 形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是[Ar]__ ,基态Ga原子核外电子占据最高能级的电子云轮廓图为___ 。
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为___ 。乙炔钠中存在___ (填字母)。
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为____ 。写出和该阴离子互为等电子体的一种分子的结构式___ 。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是____ 。
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是___ 。
(6)某离子晶体的晶胞结构如图所示。

①晶体中在每个X周围与它最近且距离相等的X共有___ 个。
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加 德罗常数为NA,则晶体中两个最近的X间的距离为___ cm。
(1)基态Ga原子的核外电子排布式是[Ar]
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是
(6)某离子晶体的晶胞结构如图所示。

①晶体中在每个X周围与它最近且距离相等的X共有
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加 德罗常数为NA,则晶体中两个最近的X间的距离为
您最近一年使用:0次
2020-03-03更新
|
283次组卷
|
3卷引用:湖北省襄阳市优质高中2020届高三联考理科综合化学试题



