1 . (1)氨硼烷(NH3BH3)是一种潜在的储氢材料,它可由六元环状化合物(BH=NH)3通过3CH4+2(HB=NH)3 +6H2O=3CO2 + 6H3BNH3制得。
①N原子价电子排布式是_______ ,核外电子运动状态有_______ 种。
②NH3BH3中B原子的杂化类型是_______ ,N与B之间的作用力是 _______ 。
③与(HB=NH)3互为等电子体的分子为_______ (填写分子式)。
(2)已知液态的二氧化硫可以发生类似的水自身电离反应:2SO2(l) ⇌SO2++SO 。 SO2+与氮气是等电子体,其中的σ键和π键数目之比为
。 SO2+与氮气是等电子体,其中的σ键和π键数目之比为_______ ,SO 空间构型是
空间构型是_______ 。
(3)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。Cl2O2 的沸点比H2O2低,原因是_______ 。
(4)氮化镓是一种半导体材料。如图所示,晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替(如b),顶点和面心的碳原子被Ga原子代替(如a)

①与同一个Ga原子相连的N原子构成的空间构型为_______ 。
②用三维坐标表示原子的位置( ),若A点的坐标是(0,0,0),b点的坐标是
),若A点的坐标是(0,0,0),b点的坐标是_______ 。
③阿伏加德罗常数的值为NA ,则GaN晶体的密度为ρg· cm-3。 GaN晶胞边长为_______ pm(1pm=10-12 m)。
①N原子价电子排布式是
②NH3BH3中B原子的杂化类型是
③与(HB=NH)3互为等电子体的分子为
(2)已知液态的二氧化硫可以发生类似的水自身电离反应:2SO2(l) ⇌SO2++SO
 。 SO2+与氮气是等电子体,其中的σ键和π键数目之比为
。 SO2+与氮气是等电子体,其中的σ键和π键数目之比为 空间构型是
空间构型是(3)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。Cl2O2 的沸点比H2O2低,原因是
(4)氮化镓是一种半导体材料。如图所示,晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替(如b),顶点和面心的碳原子被Ga原子代替(如a)

①与同一个Ga原子相连的N原子构成的空间构型为
②用三维坐标表示原子的位置(
 ),若A点的坐标是(0,0,0),b点的坐标是
),若A点的坐标是(0,0,0),b点的坐标是③阿伏加德罗常数的值为NA ,则GaN晶体的密度为ρg· cm-3。 GaN晶胞边长为
您最近一年使用:0次
解题方法
2 . 点击化学的代表反应为铜催化的叠氮-炔基Husigen环加成反应,NaN3、SO2F2、FSO2N2等均是点击化学中常用无机试剂。回答下列问题:
(1)基态Cu原子价电子排布式为___________ ;基态N原子未成对电子有___________ 个。
(2)F、O、N的电负性从小到大的顺序是___________ 。
(3)SO2F2中硫原子价层电子对数目为___________ ;SO2F2的沸点比FSO2N3的低,其主要原因是___________ 。
(4)NaN3是HN3的钠盐,下列有关HN3说法正确的是___________ (填字母)。
a.HN3分子呈直线型 b.HN3分子间存在氢键
c.HN3中氮原子杂化方式只有sp d.HN3与HOCN互为等电子体
(5)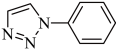 是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有
是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有___________ 个σ键。
(6)CuBr是点击化学常用的催化剂,其晶胞结构如图所示,晶胞参数为a pm。
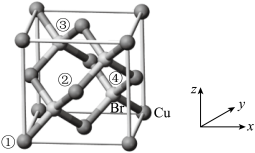
已知①、②号铜原子坐标依次为(0,0,0)、( ,0,
,0, ),则③号溴原子的坐标为
),则③号溴原子的坐标为___________ ;设NA为阿伏加德罗常数的值,CuBr的密度为___________ g·cm-3(列出计算式)。
(1)基态Cu原子价电子排布式为
(2)F、O、N的电负性从小到大的顺序是
(3)SO2F2中硫原子价层电子对数目为
(4)NaN3是HN3的钠盐,下列有关HN3说法正确的是
a.HN3分子呈直线型 b.HN3分子间存在氢键
c.HN3中氮原子杂化方式只有sp d.HN3与HOCN互为等电子体
(5)
 是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有
是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有(6)CuBr是点击化学常用的催化剂,其晶胞结构如图所示,晶胞参数为a pm。

已知①、②号铜原子坐标依次为(0,0,0)、(
 ,0,
,0, ),则③号溴原子的坐标为
),则③号溴原子的坐标为
您最近一年使用:0次
解题方法
3 . 氮及其化合物在工、农业生产中用途广泛。
(1)基态氮原子的核外电子排布式为__________ ;与N同周期的主族元素中,电负性大于N的有_______ 种。
(2)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与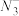 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:____________ ,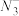 的空间构型为
的空间构型为_________ 。
(3)氮化硼(BN)和碳一样可以形成像石墨那样的平面六角形的层状结构,如图1所示,其中B原子的杂化方式为_______________ 。该氮化硼晶体具有良好的润滑性,其原因是___________________ 。

(4)一定条件下,层型BN可转变为立方氮化硼,其晶胞结构如图2所示。晶胞中B原子的配位数为_____________ ;已知晶体的密度为d g·cm-3,NA为阿伏加 德罗常数的值,则晶胞边长为__________ pm(用含d、NA的代数式表示)。
(1)基态氮原子的核外电子排布式为
(2)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与
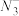 互为等电子体的分子的化学式:
互为等电子体的分子的化学式: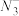 的空间构型为
的空间构型为(3)氮化硼(BN)和碳一样可以形成像石墨那样的平面六角形的层状结构,如图1所示,其中B原子的杂化方式为

(4)一定条件下,层型BN可转变为立方氮化硼,其晶胞结构如图2所示。晶胞中B原子的配位数为
您最近一年使用:0次
2020-09-25更新
|
421次组卷
|
3卷引用:广西壮族自治区玉林市2021届高三上学期11月教学质量监测理科综合化学试题
广西壮族自治区玉林市2021届高三上学期11月教学质量监测理科综合化学试题云南、四川、贵州、西藏四省名校2021届高三第一次大联考化学试题(已下线)第32讲 晶体结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)
名校
解题方法
4 . 铜、镍等金属材料在现代社会中有着重要应用。请回答下列问题:
(1)铜在元素周期表中的位置为____ ,基态镍原子的电子排布式为_____ 。
(2)氢氧化镍可生成单质镍的配合物: 。CH3NC的结构简式为
。CH3NC的结构简式为 ,1个CH3NC分子中
,1个CH3NC分子中 键的数目为
键的数目为___ , 键的数目为
键的数目为___ 。C、N、O三种元素的第一电离能由大到小的顺序为____ 。
(3)据报道,只含镁、镍、碳三种元素的晶体具有超导性。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方最密堆积,如图所示,晶体中每个镁原子周围距离最近的镍原子有______ 个。晶体中镁、镍、碳的原子个数比为_____ 。

(1)铜在元素周期表中的位置为
(2)氢氧化镍可生成单质镍的配合物:
 。CH3NC的结构简式为
。CH3NC的结构简式为 ,1个CH3NC分子中
,1个CH3NC分子中 键的数目为
键的数目为 键的数目为
键的数目为(3)据报道,只含镁、镍、碳三种元素的晶体具有超导性。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方最密堆积,如图所示,晶体中每个镁原子周围距离最近的镍原子有

您最近一年使用:0次
2020-09-21更新
|
145次组卷
|
2卷引用:广西壮族自治区北海市2019-2020学年高二下学期期末教学质量检测化学试题
名校
解题方法
5 . 已知A、B、C、D、E是原子序数依次增大的前30号元素,A元素形成的一种微粒是最简单的原子,B元素基态原子的核外有3个能级,每个能级上的电子数都相同;D的最外层电子数与能层数之比为3:1;E是第四周期元素,最外层只有一个电子,其余各层电子均充满。回答下列问题(用元素符号或化学式表示):
(1)E在元素周期表中位于____ 区。
(2)B、C、D的原子半径由大到小的顺序为_____ (填元素符号),A分别与B、C、D能形成10电子的化合物,它们的沸点由高到低的顺序是____ (填分子式)。
(3)C2A4在碱性溶液中能够将ED还原为E2D。C2A4分子中C的杂化方式是____ ,由C元素原子组成的单质分子(C2)中含____ 个π键,与单质分子(C2)互为等电子体的分子有____ 。
(1)E在元素周期表中位于
(2)B、C、D的原子半径由大到小的顺序为
(3)C2A4在碱性溶液中能够将ED还原为E2D。C2A4分子中C的杂化方式是
您最近一年使用:0次
2020-09-21更新
|
345次组卷
|
4卷引用:广西壮族自治区北海市2019-2020学年高二下学期期末教学质量检测化学试题
广西壮族自治区北海市2019-2020学年高二下学期期末教学质量检测化学试题安徽省霍邱县第二中学2019-2020学年高二下学期段考化学试题(已下线)第2章 微粒间相互作用与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)(已下线)考向37 分子结构与性质-备战2022年高考化学一轮复习考点微专题
6 . 太阳能电池材料和半导体材料对未来社会的发展有重要的作用。对铜、铅、砷化合物的研究成为科学家研究的热点。
(1)有机氯化铅CH3NH2PbCl3钙矿太阳能电池有优异的光电性能。基态氯原子中核外电子占据的最高能级符号是___ ,基态铅原子的价电子排布式是___ 。
(2)二苯氰砷结构为: 分子中碳原子杂化轨道类型为
分子中碳原子杂化轨道类型为___ ,与CN-等电子体的一种分子的电子式是___ 。
(3)Cu+与NH3形成的配合物可表示为[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对。已知下列物质键角数据:
①[Cu(NH3)n]+中n=___ ;Cu+与n个氮原子的空间结构呈___ 形。
②[Cu(NH3)n]+中∠HNH键角接近109.5°的原因是___ 。
(4)有机卤化铅(CH3NH2PbX3)的晶胞结构如图所示,与CH3NH 距离最近的Pb2+有
距离最近的Pb2+有___ 个,距离最近的CH3NH 有
有___ 个。若X-为I-,晶胞密度为dg•cm-3,则两个I-之间的最小距离为___ cm。(用NA表示阿伏加 德罗常数的值,列出计算式即可,CH3NH2PbI3相对分子质量为620)

(1)有机氯化铅CH3NH2PbCl3钙矿太阳能电池有优异的光电性能。基态氯原子中核外电子占据的最高能级符号是
(2)二苯氰砷结构为:
 分子中碳原子杂化轨道类型为
分子中碳原子杂化轨道类型为(3)Cu+与NH3形成的配合物可表示为[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对。已知下列物质键角数据:
| CH4 | NH3 | H2O | [Cu(NH3)n]+ |
| ∠HCH | ∠HNH | ∠HOH | ∠HNH |
| 109.5° | 107° | 105° | 接近109.5° |
①[Cu(NH3)n]+中n=
②[Cu(NH3)n]+中∠HNH键角接近109.5°的原因是
(4)有机卤化铅(CH3NH2PbX3)的晶胞结构如图所示,与CH3NH
 距离最近的Pb2+有
距离最近的Pb2+有 有
有
您最近一年使用:0次
名校
解题方法
7 . 氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是______________ 。基态K+的电子排布式为__________________ 。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是_______________ ,中心原子的杂化方式为__________ 。NaBH4中存在__________ (填标号)。
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为_________________ 。
(4)第三周期元素氟化物的熔点如下表:
解释表中氟化物熔点变化的原因:__________________________ 。
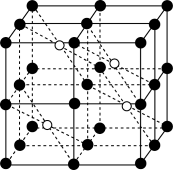
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=x pm,r(Ca2+)=y pm,设阿伏加 德罗常数的值为NA,则CaF2的密度ρ=____________________ g·cm-3(列出计算表达式)。
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为
(4)第三周期元素氟化物的熔点如下表:
| 化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
| 熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=x pm,r(Ca2+)=y pm,设阿伏加 德罗常数的值为NA,则CaF2的密度ρ=

您最近一年使用:0次
解题方法
8 . (1)Co的氯化物与氨水反应可形成配合物[CoCl(NH3)5]Cl2 ,1 mol该配合物中含有σ键的数目为_____ ,含1 mol [CoCl(NH3)5]Cl2的溶液中加入足量AgNO3溶液,生成______ mol AgCl沉淀。
(2)关于化合物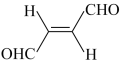 ,下列叙述正确的有
,下列叙述正确的有________ 。
A.分子间可形成氢键 B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键 D.该分子在水中的溶解度大于2-丁烯
(3) Al2O3、SiC、Si、金刚石中属于原子晶体的有______________ ,其熔点高低顺序为___________ ,其理由是__________ 。
(4)H3O+中H—O—H键角比H2O中H—O—H 键角_____ (填“大”或“小”),原因为________ 。
(2)关于化合物
 ,下列叙述正确的有
,下列叙述正确的有A.分子间可形成氢键 B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键 D.该分子在水中的溶解度大于2-丁烯
(3) Al2O3、SiC、Si、金刚石中属于原子晶体的有
(4)H3O+中H—O—H键角比H2O中H—O—H 键角
您最近一年使用:0次
名校
解题方法
9 . 铜、钛、钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为__________ ,未成对电子数为________________ 。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①与BH4-互为等电子体的阳离子的化学式为_____ 。
②H、B、Ti原子的第一电离能由小到大的顺序为_____ 。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。

化合物乙的分子中采取sp3杂化方式的原子个数为_____ 。
(4)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为___ 。阳离子的立体构型是________________ 。
(5)铜与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2中含有π键的数目为_____ ,HSCN结构有两种,已知硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S),其原因是_______ 。
(1)钴元素基态原子的电子排布式为
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①与BH4-互为等电子体的阳离子的化学式为
②H、B、Ti原子的第一电离能由小到大的顺序为
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。

化合物乙的分子中采取sp3杂化方式的原子个数为
(4)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为
(5)铜与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2中含有π键的数目为
您最近一年使用:0次
2020-05-26更新
|
99次组卷
|
2卷引用:广西钦州市第一中学2019-2020学年高二下学期5月月考理科综合化学试题
解题方法
10 . 碳及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态C原子中,核外存在_______ 对自旋方向相反的电子。
(2)丙酮( )分子中,中间碳原子的杂化方式为
)分子中,中间碳原子的杂化方式为______ ; 中
中 键和π键的数目之比为
键和π键的数目之比为__________________ .
(3)写出两个与CO2具有相同空间构型的分子或离子:_____________
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_____ 晶体;Fe3+的核外电子排布式为__________________ 。
(5)已知第IIA族元素的碳酸盐MCO3热分解的主要过程为M2+结合碳酸根离子中的O2-,释放出CO2。则CaCO3的分解温度低于BaCO3的原因是_______________ 。分子中的大π键用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则CO32-中的大π键应表示为
),则CO32-中的大π键应表示为____________ 。
(6)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,一个六元环上的C原子数为__________________ 。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接_____ 个六元环,六元环中最多有_______ 个C原子在同一平面。
(1)在基态C原子中,核外存在
(2)丙酮(
 )分子中,中间碳原子的杂化方式为
)分子中,中间碳原子的杂化方式为 中
中 键和π键的数目之比为
键和π键的数目之比为(3)写出两个与CO2具有相同空间构型的分子或离子:
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于
(5)已知第IIA族元素的碳酸盐MCO3热分解的主要过程为M2+结合碳酸根离子中的O2-,释放出CO2。则CaCO3的分解温度低于BaCO3的原因是
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则CO32-中的大π键应表示为
),则CO32-中的大π键应表示为(6)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,一个六元环上的C原子数为
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接
您最近一年使用:0次



