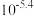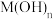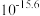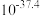名校
1 . 过硫酸钠(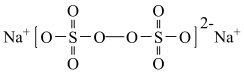 ),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对
),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对 制备和性质及用途进行探究。
制备和性质及用途进行探究。

工业制备过硫酸钠的反应原理:
主反应:

副反应:

实验室设计如图实验装置:
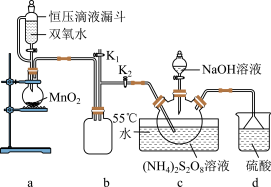
(2)装置b的作用是
(3)上述反应过程中,d装置中主要发生的化学反应方程式为
Ⅱ.探究
 的性质与用途
的性质与用途(4)
 用于废水中苯酚的降解
用于废水中苯酚的降解已知:a.
 具有强氧化性,
具有强氧化性, 浓度较高时会导致
浓度较高时会导致 淬灭。
淬灭。b.
 可将苯酚氧化,但反应速率较慢,加入
可将苯酚氧化,但反应速率较慢,加入 可加快反应。
可加快反应。过程为ⅰ.

ⅱ.
 将苯酚氧化为
将苯酚氧化为 气体
气体①
 氧化苯酚的离子方程式是
氧化苯酚的离子方程式是②将含
 的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。
的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。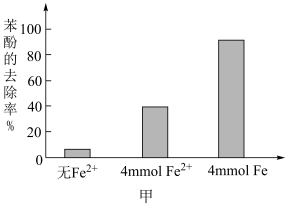
 ,可明显提高苯酚的降解率,主要原因是
,可明显提高苯酚的降解率,主要原因是(5)工业上利用
 能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含
能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含 的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为
的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为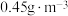 ,
, 达到最大去除率,NO去除的平均反应速率:
达到最大去除率,NO去除的平均反应速率: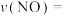
 。
。
您最近一年使用:0次
名校
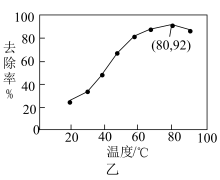
2 . 利用高压氨浸法从黄铜矿中提取铜具有提取率高、污染小等优点,被广泛使用。一种由黄铜矿(主要成分为 ,含少量
,含少量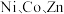 等元素)提取铜的工艺如下:
等元素)提取铜的工艺如下:
I.“固液分离”后溶液中主要离子为 ,杂质离子为
,杂质离子为 、
、 、
、 等阳离子(浓度均为
等阳离子(浓度均为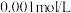 );“电积”时溶液中主要溶质为
);“电积”时溶液中主要溶质为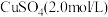 。
。
Ⅱ.不稳定常数对 ,不稳定常数
,不稳定常数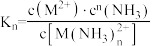
Ⅲ.溶度积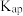
(1)基态 原子的价电子排布式为
原子的价电子排布式为________________ , 中氮原子的杂化方式为
中氮原子的杂化方式为_______________ 。
(2)①浸出前“粉碎磨矿”的目的是_______________ ,②“固液分离”用到的操作是_______________ 。
(3)①“搅拌浸出”主要成分反应的化学方程式为______________ 。(已知:硫元素变成最高价,铁元素变成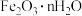 );
);
②铁元素没有以配合物离子存在的原因是__________________ 。
(4)常温下,“沉钴”步骤中,溶液中氨气分子浓度为 ,若要“沉钻”完全[
,若要“沉钻”完全[ 浓度为
浓度为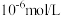 ],需调节
],需调节 至
至___________ ,“萃取”和“反萃取”的作用为________________ 。
 ,含少量
,含少量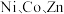 等元素)提取铜的工艺如下:
等元素)提取铜的工艺如下: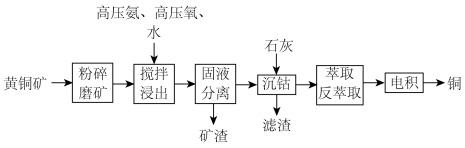
I.“固液分离”后溶液中主要离子为
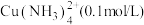 ,杂质离子为
,杂质离子为 、
、 、
、 等阳离子(浓度均为
等阳离子(浓度均为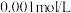 );“电积”时溶液中主要溶质为
);“电积”时溶液中主要溶质为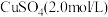 。
。Ⅱ.不稳定常数对
 ,不稳定常数
,不稳定常数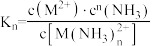
|
|
|
不稳定常数 |
| 0.2 |
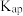
|
|
|
溶度积 |
|
|
(1)基态
 原子的价电子排布式为
原子的价电子排布式为 中氮原子的杂化方式为
中氮原子的杂化方式为(2)①浸出前“粉碎磨矿”的目的是
(3)①“搅拌浸出”主要成分反应的化学方程式为
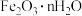 );
);②铁元素没有以配合物离子存在的原因是
(4)常温下,“沉钴”步骤中,溶液中氨气分子浓度为
 ,若要“沉钻”完全[
,若要“沉钻”完全[ 浓度为
浓度为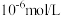 ],需调节
],需调节 至
至
您最近一年使用:0次
3 . 氯化亚铜可用作有机合成的催化剂。以黄铜矿(主要成分为 ,还含杂质
,还含杂质 )为主要原料制备
)为主要原料制备 的流程如下。已知:
的流程如下。已知: 可以溶解在氯离子浓度较大的溶液中,生成
可以溶解在氯离子浓度较大的溶液中,生成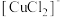 ,
,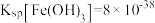 ,
,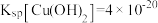 ,
, 。
。___________ (填“大于”或“小于”)锌的第二电离能,其主要原因是___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)用 溶液调节溶液的
溶液调节溶液的 的值应大于
的值应大于___________ 。
(4)“还原”过程中发生的主要反应的离子方程式为___________ ;该过程中若 的用量过多,造成的后果是
的用量过多,造成的后果是___________ 。
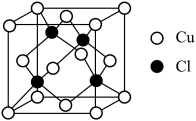
(5)氯化亚铜的立方晶胞如图所示,已知其密度为 ,
, 为阿伏加德罗常数的值,晶胞中
为阿伏加德罗常数的值,晶胞中 的配位数为
的配位数为___________ ,该晶胞参数为___________  。
。
 ,还含杂质
,还含杂质 )为主要原料制备
)为主要原料制备 的流程如下。已知:
的流程如下。已知: 可以溶解在氯离子浓度较大的溶液中,生成
可以溶解在氯离子浓度较大的溶液中,生成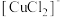 ,
,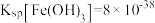 ,
,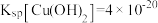 ,
, 。
。
(2)“滤渣1”的主要成分为
(3)用
 溶液调节溶液的
溶液调节溶液的 的值应大于
的值应大于(4)“还原”过程中发生的主要反应的离子方程式为
 的用量过多,造成的后果是
的用量过多,造成的后果是(5)氯化亚铜的立方晶胞如图所示,已知其密度为
 ,
, 为阿伏加德罗常数的值,晶胞中
为阿伏加德罗常数的值,晶胞中 的配位数为
的配位数为 。
。
您最近一年使用:0次
名校
解题方法
4 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)元素F简单离子的价电子排布式为___________ ;写出元素G在周期表中的位置___________ 。
(2)B与氢元素形成的简单气态氢化物的空间构型为___________ ,C与氢元素形成的简单气态氢化物的VSEPR模型为___________ 。
(3)C、D、E三种元素的简单离子半径由大到小的顺序为___________ (用元素符号表示)。
(4)已知元素A、B形成的 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为___________ 。
(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是___________ 化合物(填“离子”或“共价”);M的最高价氧化物对应的水化物与NaOH溶液反应的化学方程式为___________ 。
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 电离能数据(单位: ):738、1451、7733、10540、13630…… ):738、1451、7733、10540、13630…… |
| E | 基态原子最外层电子排布式为: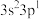 |
| F | 基态原子的最外层p轨道上2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 其中一种氧化物是有磁性的黑色固体 |
(2)B与氢元素形成的简单气态氢化物的空间构型为
(3)C、D、E三种元素的简单离子半径由大到小的顺序为
(4)已知元素A、B形成的
 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO
 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
解题方法
5 . 微颗粒的氧化锌作为一种纳米材料开始在相关领域发挥作用,利用锌焙砂 主要成分为
主要成分为 ,含
,含 及铅、铜、镉的氧化物
及铅、铜、镉的氧化物 生产高纯氧化锌的工业流程如图所示,回答下列问题:
生产高纯氧化锌的工业流程如图所示,回答下列问题:

已知: 微溶于水而生成亚砷酸
微溶于水而生成亚砷酸 和
和 难溶于水。
难溶于水。
(1)基态 原子核外价层电子轨道表达式为
原子核外价层电子轨道表达式为______ , 中
中 的化合价为
的化合价为______ 。
(2)“浸出”过程中 足量,则生成的主要配离子的化学式为
足量,则生成的主要配离子的化学式为______ ;增大浸出率可采取的措施是______  写出两条
写出两条 。
。
(3)“除砷”过程中, 作氧化剂
作氧化剂 溶液呈酸性
溶液呈酸性 ,发生反应的离子方程式为
,发生反应的离子方程式为______ 。
(4)“除重金属”过程中加入 后
后 在溶液中的残留浓度为
在溶液中的残留浓度为 ,此时
,此时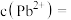
______ 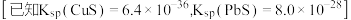 。
。
(5)“沉锌”前锌元素以 存在,写出“沉锌”的化学方程式
存在,写出“沉锌”的化学方程式______ 。
(6)流程中可循环利用的物质有 、
、______ 、______  填化学式
填化学式 。
。
 主要成分为
主要成分为 ,含
,含 及铅、铜、镉的氧化物
及铅、铜、镉的氧化物 生产高纯氧化锌的工业流程如图所示,回答下列问题:
生产高纯氧化锌的工业流程如图所示,回答下列问题:
已知:
 微溶于水而生成亚砷酸
微溶于水而生成亚砷酸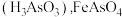 和
和 难溶于水。
难溶于水。(1)基态
 原子核外价层电子轨道表达式为
原子核外价层电子轨道表达式为 中
中 的化合价为
的化合价为(2)“浸出”过程中
 足量,则生成的主要配离子的化学式为
足量,则生成的主要配离子的化学式为 写出两条
写出两条 。
。(3)“除砷”过程中,
 作氧化剂
作氧化剂 溶液呈酸性
溶液呈酸性 ,发生反应的离子方程式为
,发生反应的离子方程式为(4)“除重金属”过程中加入
 后
后 在溶液中的残留浓度为
在溶液中的残留浓度为 ,此时
,此时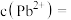
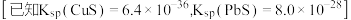 。
。(5)“沉锌”前锌元素以
 存在,写出“沉锌”的化学方程式
存在,写出“沉锌”的化学方程式(6)流程中可循环利用的物质有
 、
、 填化学式
填化学式 。
。
您最近一年使用:0次
名校
解题方法
6 . X、Y、R、Q为前四周期元素且原子序数依次增大,X的单质与氢气可以化合生成气体G,其水溶液呈碱性;Y的一种单质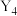 中分子为正四面体结构;R基态原子的核外有6个单电子;Q的基态原子M层电子全充满,N层只有一个电子。请回答下列问题:
中分子为正四面体结构;R基态原子的核外有6个单电子;Q的基态原子M层电子全充满,N层只有一个电子。请回答下列问题:
(1)Q元素在周期表中的位置是______ 。
(2) 价层的轨道表示式是
价层的轨道表示式是______ 。
(3)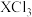 与
与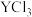 的键角大小为:
的键角大小为: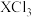
______  (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
(4)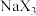 可用于安全气囊的产气药剂,
可用于安全气囊的产气药剂, 离子中中心原子的杂化方式为
离子中中心原子的杂化方式为______ 杂化。
(5)如下图所示Y可形成多种含氧酸根:
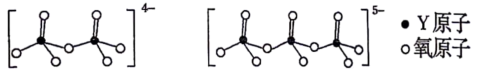
这类酸根离子的化学式可用通式表示为______ (用n代表Y原子数)。
(6)已知R元素形成的配合物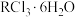 中心原子
中心原子 配位数为6,向含
配位数为6,向含 的溶液中滴加
的溶液中滴加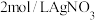 溶液,反应完全后消耗
溶液,反应完全后消耗 溶液
溶液 ,则该配离子的化学式为
,则该配离子的化学式为______ 。
(7)已知 晶体结构单元如下图所示,离H最近且等距的H的个数为
晶体结构单元如下图所示,离H最近且等距的H的个数为______ 。

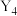 中分子为正四面体结构;R基态原子的核外有6个单电子;Q的基态原子M层电子全充满,N层只有一个电子。请回答下列问题:
中分子为正四面体结构;R基态原子的核外有6个单电子;Q的基态原子M层电子全充满,N层只有一个电子。请回答下列问题:(1)Q元素在周期表中的位置是
(2)
 价层的轨道表示式是
价层的轨道表示式是(3)
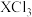 与
与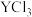 的键角大小为:
的键角大小为: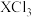
 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。(4)
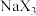 可用于安全气囊的产气药剂,
可用于安全气囊的产气药剂, 离子中中心原子的杂化方式为
离子中中心原子的杂化方式为(5)如下图所示Y可形成多种含氧酸根:

这类酸根离子的化学式可用通式表示为
(6)已知R元素形成的配合物
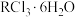 中心原子
中心原子 配位数为6,向含
配位数为6,向含 的溶液中滴加
的溶液中滴加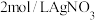 溶液,反应完全后消耗
溶液,反应完全后消耗 溶液
溶液 ,则该配离子的化学式为
,则该配离子的化学式为(7)已知
 晶体结构单元如下图所示,离H最近且等距的H的个数为
晶体结构单元如下图所示,离H最近且等距的H的个数为
您最近一年使用:0次
名校
解题方法
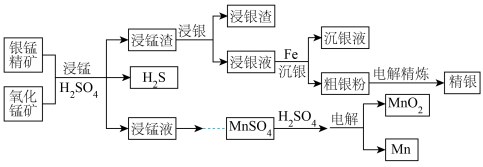
7 . 以银锰精矿(主要含 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取精银、Mn及
)为原料联合提取精银、Mn及 的一种流程示意图如下。
的一种流程示意图如下。
已知:酸性条件下, 的氧化性强于
的氧化性强于 。
。
(1)“浸锰”是在 溶液中使矿石中的锰元素浸出的过程,能同时去除
溶液中使矿石中的锰元素浸出的过程,能同时去除 ,且有利于后续银的浸出,矿石中的银以
,且有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
①“浸锰”过程中,发生反应 ,推断:
,推断: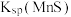
___________ 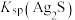 (填“>”或“<”)。
(填“>”或“<”)。
②在 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有___________ 。
(2)“浸银”时,使用过量 、HCl、
、HCl、 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整__________ 。
_______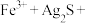 ________
________ ________
________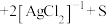
②结合平衡移动原理,解释浸出剂中 的作用:
的作用:___________ 。
(3)“电解精炼”时,将粗银粉进行“固态化”处理,制成“粗银电极”,下图为电解精炼银的示意图,

回答下列问题:
①___________ 极为“粗银电极”(填“a”或“b”)。
②若b极有少量红棕色气体产生,则生成该气体的电极反应式为___________ ;当电路中通过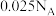 电子时,b极质量增加2.16g,则b极产生的气体在标况下的体积为
电子时,b极质量增加2.16g,则b极产生的气体在标况下的体积为___________ mL(保留三位有效数字)。
(4)电解 溶液提取Mn以及
溶液提取Mn以及 ,写出在阳极获取
,写出在阳极获取 的电极方程式
的电极方程式___________ 。
 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取精银、Mn及
)为原料联合提取精银、Mn及 的一种流程示意图如下。
的一种流程示意图如下。
已知:酸性条件下,
 的氧化性强于
的氧化性强于 。
。(1)“浸锰”是在
 溶液中使矿石中的锰元素浸出的过程,能同时去除
溶液中使矿石中的锰元素浸出的过程,能同时去除 ,且有利于后续银的浸出,矿石中的银以
,且有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①“浸锰”过程中,发生反应
 ,推断:
,推断: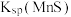
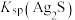 (填“>”或“<”)。
(填“>”或“<”)。②在
 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有(2)“浸银”时,使用过量
 、HCl、
、HCl、 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整
_______
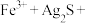 ________
________ ________
________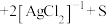
②结合平衡移动原理,解释浸出剂中
 的作用:
的作用:(3)“电解精炼”时,将粗银粉进行“固态化”处理,制成“粗银电极”,下图为电解精炼银的示意图,

回答下列问题:
①
②若b极有少量红棕色气体产生,则生成该气体的电极反应式为
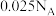 电子时,b极质量增加2.16g,则b极产生的气体在标况下的体积为
电子时,b极质量增加2.16g,则b极产生的气体在标况下的体积为(4)电解
 溶液提取Mn以及
溶液提取Mn以及 ,写出在阳极获取
,写出在阳极获取 的电极方程式
的电极方程式
您最近一年使用:0次
名校
解题方法
8 . 锰酸锂(LiMn2O4) 可作为某锂离子电池的正极材料,工业上利用软锰矿浆(主要成分为 MnO2,含少量 Fe2O3、FeO、Al2O3、SiO2。等杂质)吸收含硫烟气(主要成分 SO2) 制备锰酸锂,生产流程如图所示:

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强;
②在此流程中部分金属阳离子生成氢氧化物沉淀的 pH 如下表:
(1)含硫烟气中 SO2的VSEPR模型为___________ 。
(2)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是___________ 。
(3)请写出含硫烟气在通入软锰矿浆后与 MnO2发生反应的化学方程式:___________ 。
(4)滤液1中所含金属阳离子除 以外还有
以外还有___________ (填离子符号)。
(5)由“滤液1”得到“滤液2”同时回收 Al(OH)3的实验方案如下:边搅拌边向滤液1中加入___________ ,再加入NaOH溶液调节pH范围为___________ ,过滤得到滤液 2 和滤渣,请设计实验方案由滤渣制得纯净 Al(OH)3[Al(OH)3在 pH≥12时溶解]的实验方案:___________ 。
(6)在实际生产中, Li2CO3与 MnO2按物质的量之比1:4混合均匀在 600℃~750℃制取 LiMn2O4,请写出该反应的化学方程式:___________ 。
(7)为测定锰酸锂的纯度, 取2.00g产品置于锥形瓶中, 向其中加入2.68g Na2C2O4和足量硫酸,充分反应后,用0.100mol/L KMnO4标准溶液滴定未反应完的 H2C2O4,到达滴定终点时消耗标准 KMnO4溶液20.00mL,已知:
 则该产品中锰酸锂的质量分数为
则该产品中锰酸锂的质量分数为___________ 。

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强;
②在此流程中部分金属阳离子生成氢氧化物沉淀的 pH 如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)含硫烟气中 SO2的VSEPR模型为
(2)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是
(3)请写出含硫烟气在通入软锰矿浆后与 MnO2发生反应的化学方程式:
(4)滤液1中所含金属阳离子除
 以外还有
以外还有(5)由“滤液1”得到“滤液2”同时回收 Al(OH)3的实验方案如下:边搅拌边向滤液1中加入
(6)在实际生产中, Li2CO3与 MnO2按物质的量之比1:4混合均匀在 600℃~750℃制取 LiMn2O4,请写出该反应的化学方程式:
(7)为测定锰酸锂的纯度, 取2.00g产品置于锥形瓶中, 向其中加入2.68g Na2C2O4和足量硫酸,充分反应后,用0.100mol/L KMnO4标准溶液滴定未反应完的 H2C2O4,到达滴定终点时消耗标准 KMnO4溶液20.00mL,已知:

 则该产品中锰酸锂的质量分数为
则该产品中锰酸锂的质量分数为
您最近一年使用:0次
名校
解题方法
9 . 环氧沙星作为一种重要的喹啉酮类抗菌药物,被广泛使用于肺部、胃肠道和泌尿生殖系统的感染治疗,其重要的中间体H的合成路线如图所示:
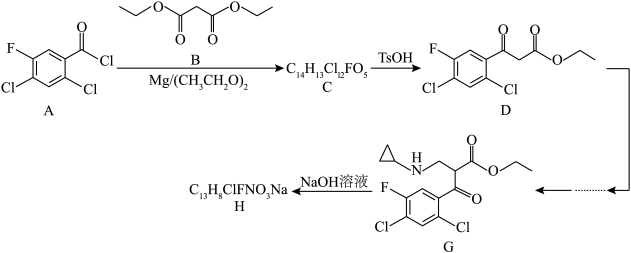
已知: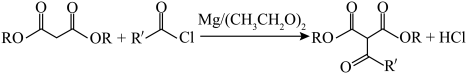
(1)B的名称为___________ ,C中官能团的名称为碳氟键、酮羰基、___________ ,D中采用 和
和 杂化的碳原子的数目比是
杂化的碳原子的数目比是___________ 。
(2)D经如下三步转化为G
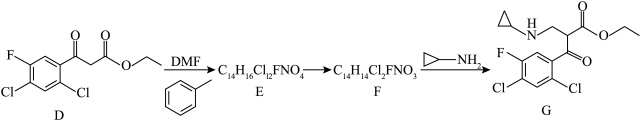
已知:DMF(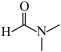 )可以发生反应
)可以发生反应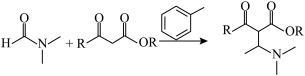
①DMF与银氨溶液反应的化学方程式为___________ 。
②满足下列条件的DMF的同分异构体有___________ 种(不考虑立体异构)。
A.分子内有含氧杂环结构 B.含有氨基(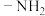 )
)
其同分异构体在下列仪器中显示信号完全相同的是___________ (填序号)。
a.X射线衍射仪 b.元素分析仪 c.红外光谱仪 d.核磁共振仪 e.质谱仪
③E的结构简式为___________ ,由E生成F的反应类型为___________ 。
(3)G生成H的反应称为环合反应。
已知: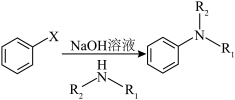 (X为卤原子,R1、R2为烃基)
(X为卤原子,R1、R2为烃基)
NaOH溶液可促进小分子脱落,且以形成五元环或六元环更为稳定,G生成H的反应方程式为___________ 。

已知:
(1)B的名称为
 和
和 杂化的碳原子的数目比是
杂化的碳原子的数目比是(2)D经如下三步转化为G

已知:DMF(
 )可以发生反应
)可以发生反应
①DMF与银氨溶液反应的化学方程式为
②满足下列条件的DMF的同分异构体有
A.分子内有含氧杂环结构 B.含有氨基(
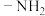 )
)其同分异构体在下列仪器中显示信号完全相同的是
a.X射线衍射仪 b.元素分析仪 c.红外光谱仪 d.核磁共振仪 e.质谱仪
③E的结构简式为
(3)G生成H的反应称为环合反应。
已知:
 (X为卤原子,R1、R2为烃基)
(X为卤原子,R1、R2为烃基)NaOH溶液可促进小分子脱落,且以形成五元环或六元环更为稳定,G生成H的反应方程式为
您最近一年使用:0次
10 . 某金属有机多孔材料(MOFA)对CO2具有超高吸附能力,并能催化CO2与环氧丙烷反应,其工作原理如图所示。下列说法错误的是
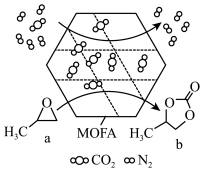

| A.b分子中碳原子采用sp2和sp3杂化 |
| B.b的一氯代物有3种 |
| C.1molb最多可与2molNaOH反应 |
| D.a转化为b发生取代反应,并有极性共价键的形成 |
您最近一年使用:0次



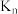 (常温)
(常温)