11-12高三上·重庆·阶段练习
1 . Ⅰ、氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物。
(1)NF3,NBr3、NCl3这三种分子的空间构型是_______ 。
(2)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-。请写出两种与N3-电子数相等的分子_______________ 。
(3)NaN3与KN3离子键强弱相比,NaN3_____ KN3(填“>”、“=”或“<” )。
(4)氮化碳结构如下图, 其硬度超过金刚石晶体,成为首屈一指的超硬新材料。

①写出氮化碳的化学式____________________ ;
②指出氮化碳的晶体类型___________________ 。
Ⅱ、分析表中四种物质的相关数据,请回答:
(1)CH4和SiH4比较,沸点高低的原因是________________________ ;
(2)NH3和PH3比较,分解温度高低的原因是____________________ ;
(3)结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时___________ 先液化。
(1)NF3,NBr3、NCl3这三种分子的空间构型是
(2)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-。请写出两种与N3-电子数相等的分子
(3)NaN3与KN3离子键强弱相比,NaN3
(4)氮化碳结构如下图, 其硬度超过金刚石晶体,成为首屈一指的超硬新材料。

①写出氮化碳的化学式
②指出氮化碳的晶体类型
Ⅱ、分析表中四种物质的相关数据,请回答:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点/K | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度/K | 873 | 773 | 1073 | 713.2 |
(1)CH4和SiH4比较,沸点高低的原因是
(2)NH3和PH3比较,分解温度高低的原因是
(3)结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时
您最近一年使用:0次
11-12高三上·重庆·阶段练习
解题方法
2 . 氮是地球上极为丰富的元素,氮元素可形成多种离子,如:N3-、NH 、NH
、NH 、N2H
、N2H 、N2H
、N2H 等。
等。
(1)请画出氮的原子结构示意图___________ 。
(2)氮的常见氢化物的结构式为________ ,其空间构型为_______ ,它极易溶于水的主要原因是________ ,溶于水后显碱性的原因是______ (用离子方程式说明)
(3)X+中所有电子正好充满K、L两个电子层,它与N3-形成的晶体结构如图1所示。与同一个N3-相连的X+有________ 个,X的元素符号是________ 。

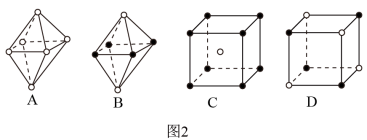
(4)最近科学家研制出某元素Z与N元素形成的晶体ZN,已知ZN晶体具有与NaCI相似的晶体结构。图2是从ZN晶体结构图中分割出来的部分结构图,试判断符合ZN晶体结构图的是_________ 。
 、NH
、NH 、N2H
、N2H 、N2H
、N2H 等。
等。(1)请画出氮的原子结构示意图
(2)氮的常见氢化物的结构式为
(3)X+中所有电子正好充满K、L两个电子层,它与N3-形成的晶体结构如图1所示。与同一个N3-相连的X+有

(4)最近科学家研制出某元素Z与N元素形成的晶体ZN,已知ZN晶体具有与NaCI相似的晶体结构。图2是从ZN晶体结构图中分割出来的部分结构图,试判断符合ZN晶体结构图的是

您最近一年使用:0次
9-10高二下·重庆·期末
解答题-结构与性质
|
适中(0.65)
|
解题方法
3 . 元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1)第VIA族元素形成的氢化物中沸点最高的是_________ (用分子式表示),原因是__________ ,该分子的空间构型为_________ 。
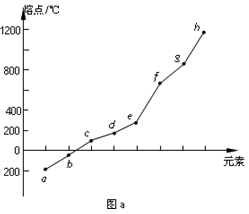
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中E的化学式为______ ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为__________ 。
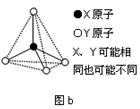
(3)第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为__________ g。
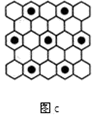
(4)碳元素的某种单质具有平面层状结构,该单质的名称为__________ ;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为__________ 。
(1)第VIA族元素形成的氢化物中沸点最高的是
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中E的化学式为
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 |  33.35 33.35 |  164 164 |

(3)第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为

(4)碳元素的某种单质具有平面层状结构,该单质的名称为

您最近一年使用:0次
4 . 下列说法中正确的是( )
| A.BF3、NF3分子的价层电子对互斥模型均为平面正三角形 |
| B.H—Cl的键能为431.8 kJ·mol—1,H—I的键能为298.7 kJ·mol—1,这可以说明HCl分子比HI分子稳定 |
| C.可燃冰是甲烷的结晶水合物,甲烷可与水形成氢键 |
| D.因为N—H键能比P—H大,所以NH3沸点比PH3高 |
您最近一年使用:0次
2016-05-03更新
|
447次组卷
|
7卷引用:2015-2016学年重庆市第八中学高二下第三次月考化学试卷
2015-2016学年重庆市第八中学高二下第三次月考化学试卷(已下线)2011-2012年重庆西南大学附中高二下学期期中考试化学试卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷河南省焦作市第一中学2022-2023学年高二下学期3月份教学质量检测 化学试题2015-2016学年河北省定州中学高二下期中化学试卷(已下线)第二章 分子结构与性质【过关测试提高卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)(已下线)第二章 分子结构与性质(A卷)
5 . 下列说法错误的是
| A.附着在试管内壁上的AgOH固体可用氨水溶解而洗去 |
| B.可用氨水鉴别AlCl3、AgNO3和CuSO4三种溶液 |
| C.向氨水中滴加CuSO4溶液至过量,先产生蓝色沉淀,然后沉淀溶解并得到深蓝色溶液 |
| D.加热碘单质,产生紫色蒸气,这个过程克服了范德华力 |
您最近一年使用:0次
2016-05-03更新
|
107次组卷
|
5卷引用:2015-2016学年重庆市第八中学高二下第三次月考化学试卷
2015-2016学年重庆市第八中学高二下第三次月考化学试卷(已下线)2011-2012年重庆西南大学附中高二下学期期中考试化学试卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷湖南省岳阳县第一中学2018届高三上学期第一次月考化学试题2015-2016学年河北省定州中学高一下期中化学试卷
11-12高二下·重庆·期中
名校
6 . 下列各组中的物质或离子都含配位键的是
| A.H2O、Al2Cl6 | B.CO2、SO |
| C.PCl5、[Co(NH3)4Cl2]Cl | D.NH4Cl、[Cu(NH3)4]SO4 |
您最近一年使用:0次
2016-05-03更新
|
138次组卷
|
7卷引用:2015-2016学年重庆市第八中学高二下第三次月考化学试卷
12-13高二下·新疆乌鲁木齐·期中
名校
7 . 下列对一些实验事实的理论解释正确的是
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C=O之间的夹角为180° |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2013-05-23更新
|
1352次组卷
|
15卷引用:重庆市清华中学2021-2022学年高二下学期期第一次月考化学试题
重庆市清华中学2021-2022学年高二下学期期第一次月考化学试题2015-2016学年江苏省启东中学高二下第二次月考化学试卷2016-2017学年宁夏银川市第二中学高二下学期第一次月考化学试卷山西省大同市第一中学2016-2017学年高二5月月考化学试题【全国百强校】山西省大同市第一中学2017-2018学年高二5月月考化学试题辽宁省大连市一0三中学2020-2021学年高二4月月考化学试题吉林省榆树市第一高级中学校2021-2022学年高三上学期第二次模拟考试化学试题(已下线)2012--2013学年新疆乌鲁木齐市一中高二下学期期中考试化学试卷(特长班)(已下线)2013届新疆乌鲁木齐市一中高二下学期特长班期中考试化学试卷2015-2016学年贵州省思南中学高二下期中化学试卷新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题山西省朔州市怀仁县大地学校2019-2020学年高二下学期期末考试化学试题辽宁省抚顺市重点高中2020-2021学年高二下学期期末考试化学试题北京市第五十五中学2023-2024学年高二下学期期中调研化学试题福建省南平市高级中学2023-2024学年高二下学期期中考试化学试题



