解题方法
1 . 化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用,其中铁和铜是两种应用广泛的元素。
(1)基态铁原子的价电子轨道表达式为_____ 。
(2)磁性材料铁氧体在制备时常加入 CH3COONa、尿素[CO(NH2)2]等碱性物质。尿素分子中所含元素的电负性由小到大的顺序是_____ ,1mol 尿素分子中含有的 σ 键数目为_____ 。 CH3COONa 中碳原子的杂化类型为_________ 。
(3)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则 Fe(CO)5的晶体类型是_____ ,写出与CO互为等电子体的分子的电子式_____ (任写一种)。
(4)CuO在高温时分解为 O2和 Cu2O,请从阳离子的结构来说明在高温时,Cu2O比 CuO更稳定的原因_____ 。
(5)磷青铜是含少量锡、磷的铜合金,某磷青铜晶胞结构如图所示:
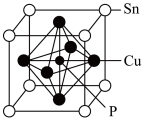
①其化学式为_____ 。
②若晶体密度为 8.82g/cm3,则最近的 Cu原子核间距为_____ pm(用含 NA的代数式表示)。
(1)基态铁原子的价电子轨道表达式为
(2)磁性材料铁氧体在制备时常加入 CH3COONa、尿素[CO(NH2)2]等碱性物质。尿素分子中所含元素的电负性由小到大的顺序是
(3)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则 Fe(CO)5的晶体类型是
(4)CuO在高温时分解为 O2和 Cu2O,请从阳离子的结构来说明在高温时,Cu2O比 CuO更稳定的原因
(5)磷青铜是含少量锡、磷的铜合金,某磷青铜晶胞结构如图所示:

①其化学式为
②若晶体密度为 8.82g/cm3,则最近的 Cu原子核间距为
您最近一年使用:0次
名校
解题方法
2 . 新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高电子层符号为__ ,该电子层具有的原子轨道数为__ 。
②LiBH4由Li+和BH4-构成,BH4-的立体构型是__ ,B原子的杂化轨道类型是___ 。
③Li、B元素的电负性由小到大的顺序为___ 。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+__ H-(填“>”“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
M是__ 族元素。
(3)图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和涂“ ”分别标明B与N的相对位置
”分别标明B与N的相对位置___ 。

(4)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为__ ,NaH的理论密度是__ g·cm-3(保留3个有效数字)。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高电子层符号为
②LiBH4由Li+和BH4-构成,BH4-的立体构型是
③Li、B元素的电负性由小到大的顺序为
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
| I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和涂“
 ”分别标明B与N的相对位置
”分别标明B与N的相对位置
(4)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为
您最近一年使用:0次
解题方法
3 . [化学——选修3:物质结构与性质]
具有自主知识产权、中国制造的C919,是一款与波音737MAX同等体量的民用飞机。制造C919需要大量的合金材料,其中包括钢,钢是现代社会的物质基础,钢中除含有铁外还含有碳和少量不可避免的硅、锰、磷、硫等元素。请回答下列有关问题:
(1)基态Mn原子的价电子排布式为___________ 。
(2)NO3-的立体构型名称为___________ ,其中心原子的杂化方式为___________ 。
(3)C、O、Si三种元素第一电离能由大到小的顺序是___________ 。
(4)写出和CN-互为等电子体的一种离子的电子式___________ 。
(5)铵盐大多易分解,NH4F和NH4Br两种盐中较易分解的是___________ (填化学式);理由是___________ 。
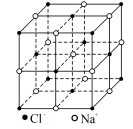
(6)氧化亚铁晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为apm,该晶体的密度为ρg·cm-3,则a=___________ (列出计算式即可,用NA表示阿伏伽德罗常数的值)。
具有自主知识产权、中国制造的C919,是一款与波音737MAX同等体量的民用飞机。制造C919需要大量的合金材料,其中包括钢,钢是现代社会的物质基础,钢中除含有铁外还含有碳和少量不可避免的硅、锰、磷、硫等元素。请回答下列有关问题:
(1)基态Mn原子的价电子排布式为
(2)NO3-的立体构型名称为
(3)C、O、Si三种元素第一电离能由大到小的顺序是
(4)写出和CN-互为等电子体的一种离子的电子式
(5)铵盐大多易分解,NH4F和NH4Br两种盐中较易分解的是
(6)氧化亚铁晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为apm,该晶体的密度为ρg·cm-3,则a=

您最近一年使用:0次
名校
解题方法
4 . 常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs 太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)基态亚铜离子(Cu+)的价电子排布图为_________ ;高温下CuO 容易转化为Cu2O,试从原子结构角度解释原因:_____ 。
(2)镓、砷、硒三种元素位于第四周期,其第一电离能从大到小的顺序为_____ (用元素符号表示)
(3)GaCl3和AsF3的立体构型分别是_____ ,_____ 。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH) 4]-中B 原子的杂化类型为_____ 。②[B(OH)4 ]-的结构式为_____ 。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
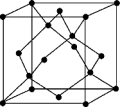
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是_____ (用化学式表示);②金刚石的晶胞参数为a pm(1pm=10-12 m)。1cm3晶体的平均质量为_____ g(只要求列算式,阿伏伽德罗常数为NA)。
(1)基态亚铜离子(Cu+)的价电子排布图为
(2)镓、砷、硒三种元素位于第四周期,其第一电离能从大到小的顺序为
(3)GaCl3和AsF3的立体构型分别是
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH) 4]-中B 原子的杂化类型为
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是
您最近一年使用:0次
2019-03-15更新
|
279次组卷
|
3卷引用:重庆第二外国语学校2020-2021学年度高三下学期高三5月诊断考试化学试题
重庆第二外国语学校2020-2021学年度高三下学期高三5月诊断考试化学试题(已下线)广东省汕头市2019届普通高中毕业班第一次模拟考试理科化学 2020届高三化学二轮选修大题必练—— 物质结构与性质大题练
名校
5 . 离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:
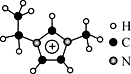
(1)碳原子价层电子的轨道表达式为__________ ,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_________ 形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_______ 。NH3比PH3的沸点高,原因是_________ 。
(3)氮元素的第一电离能比同周期相邻元素都大的原因是____________ 。
(4)EMIM+离子中,碳原子的杂化轨道类型为______ 。分子中的大π键可用符号 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为 ),则EMIM+离子中的大π键应表示为
),则EMIM+离子中的大π键应表示为________ 。
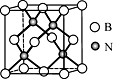
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于_______ 晶体,其中硼原子的配位数为_______ 。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏伽德罗常数的值为NA,则该晶胞中原子的空间利用率为________ (列出化简后的计算式)。

(1)碳原子价层电子的轨道表达式为
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是
(3)氮元素的第一电离能比同周期相邻元素都大的原因是
(4)EMIM+离子中,碳原子的杂化轨道类型为
 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为 ),则EMIM+离子中的大π键应表示为
),则EMIM+离子中的大π键应表示为
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于
您最近一年使用:0次
2019-01-14更新
|
1545次组卷
|
5卷引用:【全国百强校】重庆南开中学高2019届高三下学期4月考试理科综合化学试题
名校
解题方法
6 . 铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:
(1)画出基态Cu原子的价电子排布图__________________ ;
(2)已知高温下Cu2O比CuO稳定,从核外电子排布角度解释高温下Cu2O更稳定的原因_________________________________________________________________________ 。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是____________ ,配体中提供孤对电子的原子是____________ 。C、N、O三元素的第一电离能由大到小的顺序是__________ (用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图1所示,则晶体铜原子的堆积方式为________________ 。
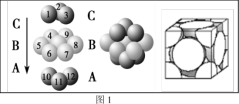
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(白球代表铜原子)。
①该晶体的化学式为_________________ 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于_________ 化合物(填“离子”、“共价”)
③已知该晶体的密度为 g/cm3,阿伏伽德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为
g/cm3,阿伏伽德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_________ pm(写出计算式)。
(1)画出基态Cu原子的价电子排布图
(2)已知高温下Cu2O比CuO稳定,从核外电子排布角度解释高温下Cu2O更稳定的原因
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是
(4)铜晶体中铜原子的堆积方式如图1所示,则晶体铜原子的堆积方式为


(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(白球代表铜原子)。
①该晶体的化学式为
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于
③已知该晶体的密度为
 g/cm3,阿伏伽德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为
g/cm3,阿伏伽德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为
您最近一年使用:0次
2018-08-29更新
|
712次组卷
|
2卷引用:【全国百强校】重庆市西南大学附属中学校2018届高三第六次月考(3月)理科综合化学试题
名校
解题方法
7 . A、B、C、D、E为原子序数依次增大的前四周期元素,A是原子半径最小的元素,B元素有两个未成对电子,D元素的最外层电子是内层电子数的三倍,E的单质是自然界中最硬的金属,常用于制作合金,且其未成对电子数在同周期中最多。回答下列问题:
(1)利用原子发生跃迁时吸收或释放出的光用于鉴定E元素,该方法是________ ,其价层电子排布图为____________ ,根据_____________ 原理,该基态原子的电子排布应使其能量处于最低状态。
(2)根据电子排布,C元素处于周期表中_______ 区;根据元素周期律,电负性B_______ C,第一电离能C________ D(填“大于”、“小于”或者“等于”)。
(3)化合物A2D分子空间构型是_____________ ;A与C以原子个数比2:1形成的分子中C原子的杂化方式为_________ ,它是_________ 分子(填“极性”或“非极性”),且该分子可以与很多金属离子形成配合物,其中提供孤对电子的原子是____________ (填元素符号)。
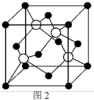
(4)生活中常见的B元素的同素异形体有两种,其结构为图1、图2所示:
①图1所对应的同素异形体可以导电,试从其结构予以解释_________ 。
②图2所对应的同素异形体的晶胞如图3,若B原子的半径为a nm,则该晶胞的空间利用率为_____________ 。(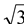 =1.732,结果保留一位小数)
=1.732,结果保留一位小数)
(1)利用原子发生跃迁时吸收或释放出的光用于鉴定E元素,该方法是
(2)根据电子排布,C元素处于周期表中
(3)化合物A2D分子空间构型是
(4)生活中常见的B元素的同素异形体有两种,其结构为图1、图2所示:

①图1所对应的同素异形体可以导电,试从其结构予以解释
②图2所对应的同素异形体的晶胞如图3,若B原子的半径为a nm,则该晶胞的空间利用率为
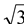 =1.732,结果保留一位小数)
=1.732,结果保留一位小数)
您最近一年使用:0次
名校
解题方法
8 . 钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________ ,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________ 种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________ 。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________ 。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
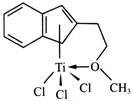
①组成M的元素中,电负性最大的是_________ (填名称)。
②M中碳原子的杂化方式为____________ 。
③M中不含________ (填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
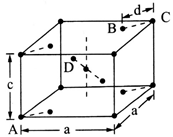
①A、B、C、D 4种微粒,其中氧原子是________ (填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____ ,___ );钛氧键的键长d=______ (用代数式表示)。
(1)基态钛原子的价电子排布式为
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。

①组成M的元素中,电负性最大的是
②M中碳原子的杂化方式为
③M中不含
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。

①A、B、C、D 4种微粒,其中氧原子是
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,
您最近一年使用:0次
2018-05-28更新
|
614次组卷
|
6卷引用:重庆市2019-2020学年高三下学期网络考试化学试题
名校
解题方法
9 . (1)基态溴原子的核外电子排布式为________ ,其核外电子所占用的最高能级电子云形状为_________ 。
(2)尿素(H2NCONH2)分子中,原子杂化轨道类型有_____ ,σ键与π键数目之比为______ 。
(3)铍与铝元素性质相似。下列有关铍与铝的叙述正确的是_____ (填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液都呈酸性
(4) NH3分子中∠HNH键角为107°,而配离子[Zn(NH3)6]2+中∠HNH的键角为109.5°。配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是_______ 。
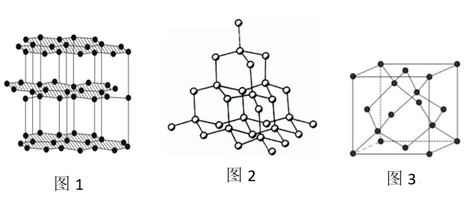
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
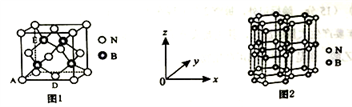
①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0, 0),D为(0.5,0.5, 0),则E原子的坐标参数为________ 。
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的表达式为___ pm.
(2)尿素(H2NCONH2)分子中,原子杂化轨道类型有
(3)铍与铝元素性质相似。下列有关铍与铝的叙述正确的是
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液都呈酸性
(4) NH3分子中∠HNH键角为107°,而配离子[Zn(NH3)6]2+中∠HNH的键角为109.5°。配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0, 0),D为(0.5,0.5, 0),则E原子的坐标参数为
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的表达式为
您最近一年使用:0次
解题方法
10 . 磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷的化合物在药物生产和农药制造等方面用途非常广泛。请回答下列有关问题:
(1)画出基态P 原子的核外电子排布图__________ 。
(2)NH3比PH3 易液化的原因是_________ 。
(3)P4S3可用于制造火柴,其结构如图1所示。

①P4S3中硫原子的杂化轨道类型为________ 。
②电负性: 磷_____ 硫(填“>”或“<”);第一电离能磷大于硫的原因是________ 。
(4)NH4BF4是合成氮化硼纳米管的原料之一,1mol NH4BF4中含有____ mol 配位键。
(5)NF3的键角小于NH3的键角,其原因是____________ 。
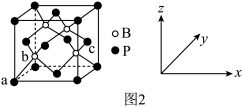
(6)磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2 所示。原子坐标参数表示晶胞内部各原子的相对位置,图中a 点和c 点的原子坐标参数依次为(0,0,0)、(1, ,
, ),则b点的原子坐标参数为
),则b点的原子坐标参数为________ ;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为_____ g.cm-3(阿伏伽德罗常数用NA表示,列出计算式即可)。
(1)画出基态P 原子的核外电子排布图
(2)NH3比PH3 易液化的原因是
(3)P4S3可用于制造火柴,其结构如图1所示。

①P4S3中硫原子的杂化轨道类型为
②电负性: 磷
(4)NH4BF4是合成氮化硼纳米管的原料之一,1mol NH4BF4中含有
(5)NF3的键角小于NH3的键角,其原因是
(6)磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2 所示。原子坐标参数表示晶胞内部各原子的相对位置,图中a 点和c 点的原子坐标参数依次为(0,0,0)、(1,
 ,
, ),则b点的原子坐标参数为
),则b点的原子坐标参数为
您最近一年使用:0次



