名校
解题方法
1 . 下列关于 、
、 、
、 三种微粒的说法不正确的是
三种微粒的说法不正确的是
 、
、 、
、 三种微粒的说法不正确的是
三种微粒的说法不正确的是| A.三种微粒所含有的电子数相等 |
| B.三种微粒中氮原子的杂化方式相同 |
| C.三种微粒的空间构型相同 |
D.键角大小关系:NH >NH3>NH >NH3>NH |
您最近一年使用:0次
2023-06-24更新
|
567次组卷
|
22卷引用:2015-2016学年黑龙江省哈尔滨九中高二下期末化学试卷
2015-2016学年黑龙江省哈尔滨九中高二下期末化学试卷黑龙江省哈尔滨市宾县第二中学2021-2022学年高二下学期期末考试化学试题四川省成都市蒲江县蒲江中学2020-2021学年高二3月月考化学试题陕西省宝鸡市金台区2020-2021学年高二下学期期中考试化学试题新疆新源县第二中学2020-2021学年高二下学期期末联考化学试题(已下线)2.2.2 杂化轨道理论简介-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)2.2.3 分子的空间结构及中心原子杂化轨道类型的判断方法-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)云南省凤庆县第一中学2021-2022学年高二下学期3月份考试化学试题专题4 分子空间结构与物质性质 本专题复习提升专题强化练4 微粒的空间结构(已下线)【知识图鉴】单元讲练测选择性必修2第二章02练基础(已下线)【知识图鉴】单元讲练测选择性必修2第二章01讲核心辽宁省部分重点中学2022-2023学年高二上学期期末联考化学试题辽宁省鞍山市普通高中2022-2023学年高二下学期第一次月考化学(A卷)试题山东省泰安市2022-2023学年高二下学期4月期中考试化学试题四川省广元中学2022-2023学年高二下学期4月月考化学试题安徽省安庆市第二中学2022-2023学年高二下学期期中考试化学试题陕西师范大学附属中学2022-2023学年高二下学期期末考试化学试题辽宁省丹东市第二中学 大石桥市第三高级中学2022-2023学年高二上学期期末联考化学试题广东省东莞实验中学2022-2023学年高二上学期第一次月考化学试题北京师范大学附属中学2023-2024学年高二上学期期末考试化学试卷(已下线)热点04 分子的空间结构
名校
2 . 根据所学化学知识填空。
Ⅰ.铁及其化合物在生活中用途广泛,绿矾(FeSO4·7H2O)是一种常见的中草药成分,失水后可转为FeSO4·H2O,FeSO4·H2O结构如图所示:

(1)从结构的角度看,Fe2+不如Fe3+稳定,原因是_____ 。
(2)SO 和H2O分子比较,
和H2O分子比较,_____ 的键角更大。
(3)S原子核外有_____ 种能量不同的电子。
Ⅱ.物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。根据所学知识,回答问题:
(4)一定温度下,向1L0.1mol/LCH3COOH溶液中加入少量CH3COONa固体,则溶液中 的值
的值_____ (填“增大”、“减小”或“不变”)。
(5)25℃下,有浓度均为0.1mol/L的三种溶液:a.Na2CO3;b.NaClO;c.CH3COONa(已知25℃时电离常数:H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;HClO:Ka=3.0×10-8;CH3COOH:Ka=1.8×10-5)往等浓度的Na2CO3、NaClO的混合溶液中加入少量醋酸,请写出发生反应的离子方程式_____ 。
(6)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银固体分别放入:a.100mL蒸馏水中b.100mL0.2mol/LAgNO3溶液中;c.100mL0.1mol/L氯化铝溶液中;d.100mL0.1mol/L盐酸溶液中;充分搅拌后,相同温度下银离子浓度由大到小的顺序是_____ (填序号)。
(7)含Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O 。为了使废水的排放达标,进行如图处理:
。为了使废水的排放达标,进行如图处理:

常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=_____ 。备注:Ksp[Cr(OH)3]=6.0×10-31 Kw=1×10-14
Ⅰ.铁及其化合物在生活中用途广泛,绿矾(FeSO4·7H2O)是一种常见的中草药成分,失水后可转为FeSO4·H2O,FeSO4·H2O结构如图所示:

(1)从结构的角度看,Fe2+不如Fe3+稳定,原因是
(2)SO
 和H2O分子比较,
和H2O分子比较,(3)S原子核外有
Ⅱ.物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。根据所学知识,回答问题:
(4)一定温度下,向1L0.1mol/LCH3COOH溶液中加入少量CH3COONa固体,则溶液中
 的值
的值(5)25℃下,有浓度均为0.1mol/L的三种溶液:a.Na2CO3;b.NaClO;c.CH3COONa(已知25℃时电离常数:H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;HClO:Ka=3.0×10-8;CH3COOH:Ka=1.8×10-5)往等浓度的Na2CO3、NaClO的混合溶液中加入少量醋酸,请写出发生反应的离子方程式
(6)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银固体分别放入:a.100mL蒸馏水中b.100mL0.2mol/LAgNO3溶液中;c.100mL0.1mol/L氯化铝溶液中;d.100mL0.1mol/L盐酸溶液中;充分搅拌后,相同温度下银离子浓度由大到小的顺序是
(7)含Cr2O
 的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O 。为了使废水的排放达标,进行如图处理:
。为了使废水的排放达标,进行如图处理:
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=
您最近一年使用:0次
名校
3 . 氨基酸是构成人体必备蛋白质的基础,某氨基酸的结构简式如图所示。下列有关说法正确的是
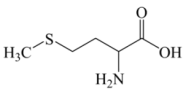

| A.第一电离能:O>N>C>H |
| B.基态氧原子的电子有8种空间运动状态 |
| C.键的稳定性大小:N-H>O-H>F-H |
| D.该分子中的氧原子均满足8电子稳定结构 |
您最近一年使用:0次
2023-03-21更新
|
457次组卷
|
3卷引用:黑龙江省大庆实验中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
4 . 下列说法正确的是
| A.P4和CH4都是正四面体分子,且键角都是109°28′ |
| B.乙炔分子中,碳原子的sp杂化轨道形成σ键,未杂化的2p轨道形成π键 |
| C.键长H-F<H-Cl<H-Br<H-I,因此稳定性HF<HCl<HBr<HI |
| D.PH3分子中孤电子对与成键电子对的排斥作用比成键电子对之间的排斥作用弱 |
您最近一年使用:0次
2023-03-06更新
|
494次组卷
|
4卷引用:黑龙江省大庆铁人中学2022-2023学年高二上学期期末考试化学试题
名校
5 . C、O、S、 、
、 、
、 等元素的单质及化合物在诸多领域都有广泛应用。回答下列问题:
等元素的单质及化合物在诸多领域都有广泛应用。回答下列问题:
(1) 元素在元素周期表的位置是
元素在元素周期表的位置是_______ ,基态 原子能量最高的电子占据的原子轨道的形状是
原子能量最高的电子占据的原子轨道的形状是_______ ,基态 原子的简化电子排布式为
原子的简化电子排布式为_______ 。
(2)基态S原子的价层电子轨道表示式为_______ , 属于
属于_______ 分子(填“极性”或“非极性”)。
(3) 的键角
的键角_______  的键角(填“>”、“<”或“=”),理由是
的键角(填“>”、“<”或“=”),理由是_______
(4)琥珀酸亚铁片是预防和治疗缺铁性贫血的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是_______ 。 比
比 的离子半径小,原因是
的离子半径小,原因是_______ 。
 、
、 、
、 等元素的单质及化合物在诸多领域都有广泛应用。回答下列问题:
等元素的单质及化合物在诸多领域都有广泛应用。回答下列问题:(1)
 元素在元素周期表的位置是
元素在元素周期表的位置是 原子能量最高的电子占据的原子轨道的形状是
原子能量最高的电子占据的原子轨道的形状是 原子的简化电子排布式为
原子的简化电子排布式为(2)基态S原子的价层电子轨道表示式为
 属于
属于(3)
 的键角
的键角 的键角(填“>”、“<”或“=”),理由是
的键角(填“>”、“<”或“=”),理由是(4)琥珀酸亚铁片是预防和治疗缺铁性贫血的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成
 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是 比
比 的离子半径小,原因是
的离子半径小,原因是
您最近一年使用:0次
2023-03-05更新
|
385次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
6 . 下列说法错误的是
A. 、 、 、 、 分子中,中心原子上的孤电子对数最多的是 分子中,中心原子上的孤电子对数最多的是 |
B.有机物 中, 中, 键和 键和 键的比例为 键的比例为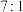 |
C.某元素气态基态原子的逐级电离能 依次为:738、1451、7733、10540、13630……,当它与氯气反应时生成物的化学式为 依次为:738、1451、7733、10540、13630……,当它与氯气反应时生成物的化学式为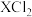 |
D. 和 和 都是正四面体形分子, 都是正四面体形分子, 键角为 键角为 , , 键角为 键角为 |
您最近一年使用:0次
名校
解题方法
7 . 冠醚是由多个二元醇分子之间脱水形成的环状化合物。18-冠-6可用作相转移催化剂,其与 形成的螯合离子结构如图所示。下列说法错误的是
形成的螯合离子结构如图所示。下列说法错误的是
 形成的螯合离子结构如图所示。下列说法错误的是
形成的螯合离子结构如图所示。下列说法错误的是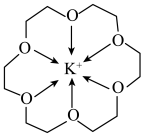
| A.该螯合离子中碳与氧原子具有相同的杂化类型 |
| B.该螯合离子中所有非氢原子可以位于同一平面 |
| C.该螯合离子中极性键与非极性键的个数比为7∶1 |
D.与二甲醚( )相比,该螯合离子中“C-O-C”键角更大 )相比,该螯合离子中“C-O-C”键角更大 |
您最近一年使用:0次
2023-02-08更新
|
2371次组卷
|
11卷引用:黑龙江省富锦市第一中学2022-2023学年高二下学期第一次考试化学试题
黑龙江省富锦市第一中学2022-2023学年高二下学期第一次考试化学试题山东省济南市2023届高三下学期学情检测(一模)化学试题(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(选择题6-10)山西省孝义市2022-2023学年高二4月月考化学试卷山东省聊城市2022-2023学年高三下学期开学考试化学试题(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)广东省深圳市盐田高级中学2022-2023学年高二下学期第一次月考化学试题 (已下线)选择题11-15辽宁省朝阳市建平县实验中学2023-2024学年高二上学期12月月考化学试题山东省烟台第一中学2023-2024学年高三下学期2月份开学考试化学试题湖北省部分省级示范高中2023-2024学年高二下学期4月期中测试化学试题
名校
8 . 下列关于物质的结构或性质及解释均正确的是
选项 | 物质的结构或性质 | 解释 |
A | 键角:H2O>NH3 | 水分子中O上孤电子对数比氨分子中N上的多 |
B | 热稳定性:NH3>PH3 | NH3分子间氢键强于PH3分子间作用力 |
C | 熔点:晶体硅>碳化硅 | Si-Si的键能大于C-Si的键能 |
D | 电子云半径:3s>1s | 3s电子能量高,在离核更远的区域出现的概率大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-05更新
|
494次组卷
|
4卷引用: 黑龙江省哈尔滨市双城区兆麟中学2022-2023学年高二下学期期中考试化学试题
名校
解题方法
9 . 法匹拉韦是治疗新冠肺炎的一种药物,其结构如图所示。下列说法错误的是


| A.该分子中所含元素中电负性最小的是H |
| B.该分子中C﹣F键的键能大于C﹣N键的键能 |
| C.该分子中所有C原子都为sp2杂化 |
| D.该分子中σ键与π键数目之比为7:2 |
您最近一年使用:0次
2023-01-13更新
|
585次组卷
|
5卷引用:黑龙江省齐齐哈尔市第八中学校2022-2023学年高二下学期4月月考化学试题
名校
10 . 下列说法正确的是
| A.非极性分子中的原子上一定不含孤电子对 |
| B.ABn型分子的中心原子最外层满足8电子稳定结构,则ABn不一定是非极性分子 |
| C.二氯甲烷(CH2Cl2)分子的中心原子采取sp3杂化,分子中键角均为109°28′ |
| D.平面三角形分子一定是非极性分子 |
您最近一年使用:0次
2023-01-13更新
|
187次组卷
|
3卷引用:黑龙江省哈尔滨市第四中学校2022-2023学年高二下学期4月月考化学试题
黑龙江省哈尔滨市第四中学校2022-2023学年高二下学期4月月考化学试题吉林省吉林第一中学2022-2023学年高二上学期11月月考化学试题(已下线)第05讲 分子结构与物质的性质-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)



