名校
解题方法
1 . Ⅰ.8−羟基喹啉( )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(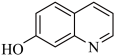 )、6−羟基喹啉(
)、6−羟基喹啉(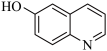 )的熔点的原因是
)的熔点的原因是___________ 。
(2) 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是___________ 。
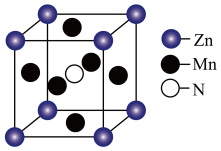
(3)某种含 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为___________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ. 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。

(4)与 距离最近且相等的
距离最近且相等的 有
有___________ 个,与 距离最近且相等的F-有
距离最近且相等的F-有___________ 个。
(5) 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
___________  。(
。( )
)
(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。
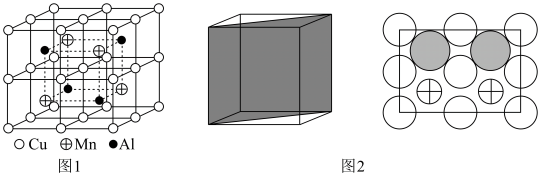
将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是___________ 。
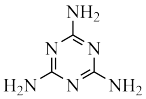
 )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(
 )、6−羟基喹啉(
)、6−羟基喹啉( )的熔点的原因是
)的熔点的原因是(2)
 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是(3)某种含
 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ.
 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。
(4)与
 距离最近且相等的
距离最近且相等的 有
有 距离最近且相等的F-有
距离最近且相等的F-有(5)
 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
 。(
。( )
)(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。

将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
A.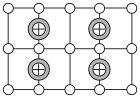 | B.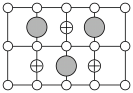 |
C. | D.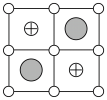 |
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是

您最近一年使用:0次
名校
解题方法
2 . 氮元素可形成丰富的化合物,在生产生活中具有广泛用途。
(1) 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为_____ ;从轨道重叠方式的角度分析 的成键,
的成键, 分子中氮原子的
分子中氮原子的_____ 轨道与氢原子的 轨道重叠形成
轨道重叠形成 键。
键。
(2) 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
_____ (填“>”或“<”) 。
。
(3) (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
① 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是_____
②比较沸点:
_____ (填“>”或“<”,下同) ,水溶性:
,水溶性:
_____  。
。
(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
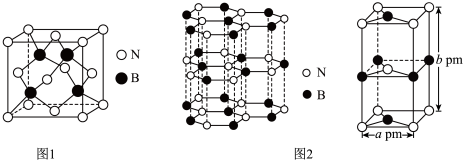
 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为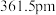 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为_____ (只列计算式) 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
_____ (列含a、b、d的计算式即可)
(1)
 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为 的成键,
的成键, 分子中氮原子的
分子中氮原子的 轨道重叠形成
轨道重叠形成 键。
键。(2)
 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
 。
。(3)
 (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。①
 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是②比较沸点:

 ,水溶性:
,水溶性:
 。
。(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为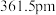 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
您最近一年使用:0次
2024-04-02更新
|
444次组卷
|
3卷引用:第三章晶体结构与性质(B卷)
3 . 化学学习中常采用“类推”思维,下列类推合理的是
| A.硫粉易溶于CS2,可类推硫粉易溶于CCl4 |
B. 是分子晶体,可类推 是分子晶体,可类推 为分子晶体 为分子晶体 |
C. 属于共价晶体,可类推 属于共价晶体,可类推 属于共价晶体 属于共价晶体 |
D. 由于键能大而结构稳定,则 由于键能大而结构稳定,则 键能也大,结构也很稳定 键能也大,结构也很稳定 |
您最近一年使用:0次
解题方法
4 . 下列有关物质结构与性质的说法错误的是
| A.键角:PH3>NH3 | B.离子键成分的百分数:Ca3N2>Mg3N2 |
| C.原子半径:Be>B | D.电离常数 :三氟乙酸>三氯乙酸 :三氟乙酸>三氯乙酸 |
您最近一年使用:0次
名校
解题方法
5 . 下列关于 、
、 、
、 三种微粒的说法不正确的是
三种微粒的说法不正确的是
 、
、 、
、 三种微粒的说法不正确的是
三种微粒的说法不正确的是| A.三种微粒所含有的电子数相等 |
| B.三种微粒中氮原子的杂化方式相同 |
| C.三种微粒的空间构型相同 |
D.键角大小关系:NH >NH3>NH >NH3>NH |
您最近一年使用:0次
2023-06-24更新
|
567次组卷
|
22卷引用:专题4 分子空间结构与物质性质 本专题复习提升
专题4 分子空间结构与物质性质 本专题复习提升(已下线)【知识图鉴】单元讲练测选择性必修2第二章02练基础(已下线)【知识图鉴】单元讲练测选择性必修2第二章01讲核心2015-2016学年黑龙江省哈尔滨九中高二下期末化学试卷四川省成都市蒲江县蒲江中学2020-2021学年高二3月月考化学试题陕西省宝鸡市金台区2020-2021学年高二下学期期中考试化学试题新疆新源县第二中学2020-2021学年高二下学期期末联考化学试题(已下线)2.2.2 杂化轨道理论简介-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)2.2.3 分子的空间结构及中心原子杂化轨道类型的判断方法-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)云南省凤庆县第一中学2021-2022学年高二下学期3月份考试化学试题专题强化练4 微粒的空间结构黑龙江省哈尔滨市宾县第二中学2021-2022学年高二下学期期末考试化学试题辽宁省部分重点中学2022-2023学年高二上学期期末联考化学试题辽宁省鞍山市普通高中2022-2023学年高二下学期第一次月考化学(A卷)试题山东省泰安市2022-2023学年高二下学期4月期中考试化学试题四川省广元中学2022-2023学年高二下学期4月月考化学试题安徽省安庆市第二中学2022-2023学年高二下学期期中考试化学试题陕西师范大学附属中学2022-2023学年高二下学期期末考试化学试题辽宁省丹东市第二中学 大石桥市第三高级中学2022-2023学年高二上学期期末联考化学试题广东省东莞实验中学2022-2023学年高二上学期第一次月考化学试题北京师范大学附属中学2023-2024学年高二上学期期末考试化学试卷(已下线)热点04 分子的空间结构
21-22高二下·全国·单元测试
6 . 下列事实不能用键能的大小来解释的是
| A.N元素的电负性较大,但N2的化学性质很稳定 |
| B.稀有气体一般难发生反应 |
| C.HF、HCl、HBr、HI的稳定性逐渐减弱 |
| D.O2比N2更容易与H2反应 |
您最近一年使用:0次
解题方法
7 . 碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
(1)金刚石、石墨、C60.、碳纳米管等都是碳元素的单质形式,它们互为_______ 。
(2)石墨烯(指单层石墨)中碳原子的杂化形式_______ 。
(3)C60属于_______ 晶体。
(4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的σ键,而石墨层内的C-C间不仅存在σ键,还有_______ 键。
(5)若金刚石晶胞的晶胞参数a=365.6 pm,其密度为_______ g·cm-3(列出计算式即可)。
(6)Ge与C是同族元素,比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_______ 。
(7)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。

①关于这两种晶体的说法,正确的是_______ (填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键 d.两种晶体均为分子晶体
② NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一、1molNH4BF4含有_______ mol配位键。

回答下列问题:
(1)金刚石、石墨、C60.、碳纳米管等都是碳元素的单质形式,它们互为
(2)石墨烯(指单层石墨)中碳原子的杂化形式
(3)C60属于
(4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的σ键,而石墨层内的C-C间不仅存在σ键,还有
(5)若金刚石晶胞的晶胞参数a=365.6 pm,其密度为
(6)Ge与C是同族元素,比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(7)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。

①关于这两种晶体的说法,正确的是
a.立方相氮化硼含有σ键和π键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键 d.两种晶体均为分子晶体
② NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一、1molNH4BF4含有
您最近一年使用:0次
2022-10-24更新
|
677次组卷
|
2卷引用:第三章 晶体结构与性质(A卷·知识通关练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)
名校
8 . 科学家进行了利用CaF2晶体中释放出的Ca2+和F-脱除硅烷的研究,拓展了金属氟化物材料的生物医学功能。下列说法正确的是
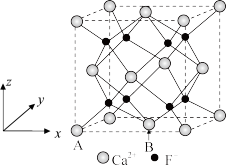

| A.F、Si和Ca三种元素均位于元素周期表的p区 |
| B.键能:Si-O键>Si-Si键,因此自然界中硅元素以二氧化硅或硅酸盐形式存在为主 |
C.CaF2晶胞中,A处原子分数坐标为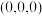 ,则B处原子分数坐标为 ,则B处原子分数坐标为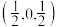 |
D.脱除硅烷反应速率高度依赖晶体提供自由氟离子的能力,因此脱除硅烷能力: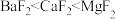 |
您最近一年使用:0次
2022-08-22更新
|
759次组卷
|
4卷引用:专题3 综合检测(提升卷)
解题方法
9 . 近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe、Sm、As、F、O组成的化合物。下列说法正确的是
| A.元素As与N同族,可预测AsH3分子中As-H键间的键角大于NH3中N-H键间的键角 |
| B.NH3的水溶液中存在不同的氢键,其中根据氨水显碱性可以推测NH3和H2O间存在的主要氢键形式可能为(NH3)N…H-O(H2O) |
| C.配合物Fe(CO)n可用作催化剂,Fe(CO)n内中心原子价电子数与配位体提供电子总数之和为18,则n=4 |
| D.每个H2O分子最多可与两个H2O分子形成两个氢键 |
您最近一年使用:0次
名校
解题方法
10 . 下列对一些事实的理论解释正确的是
| 选项 | 事实 | 理论解释 |
| A | SO 、NH3空间结构为三角锥形 、NH3空间结构为三角锥形 | SO 、NH3中心原子均为sp3杂化且均有两对孤电子对 、NH3中心原子均为sp3杂化且均有两对孤电子对 |
| B | 白磷为正四面体形分子 | 白磷分子中P-P键间的夹角是109°28′ |
| C | HF的沸点高于HCl | H-F键的键能比H-Cl键的键能大 |
| D | 硼酸固体难溶于水,加热溶解度增大 | 加热后,硼酸分子之间的氢键部分断裂,与水分子间产生氢键作用 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



