解题方法
1 . 三乙酸锰([Mn(CH3COO)3])是一种锰的配合物,在有机合成中有重要的应用价值。CH3COO―为该配合物的配体,其所含元素的电负性最大的是___________ ;FCH2COO-、ClCH2COO-也可作为配体使用,相同条件下,FCH2COO-、ClCH2COO-结合H+的能力较强的是___________ 。
您最近一年使用:0次
2 . 回答下问题:
(1)Sm的价层电子排布式为 4f66s2 ,Sm3+价层电子排布式为___________ 。
(2)依据第二周期元素第一电离能的变化规律,参照如图元素 B 、F 的位置,用小黑点标 出 C 、N 、O 三种元素的相对位置___________ 。___________ 。
(4)H2S 和 H2Se 的参数对比见下表,其中 H2S 的键角大于 H2Se 的键角的原因可能为___________
(1)Sm的价层电子排布式为 4f66s2 ,Sm3+价层电子排布式为
(2)依据第二周期元素第一电离能的变化规律,参照如图元素 B 、F 的位置,用小黑点标 出 C 、N 、O 三种元素的相对位置

(4)H2S 和 H2Se 的参数对比见下表,其中 H2S 的键角大于 H2Se 的键角的原因可能为
| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3° | -60.75 |
| H2Se | 1.47 | 91.0° | -41.50 |
您最近一年使用:0次
解题方法
3 . 一种具有高弹性的自修复聚氨酯材料(TPU)结构如下:_______ 碳氮双键的键能。
A.大于 B.等于 C.小于
2.请写出TPU中元素的第一电离能的大小关系_______ 。

该聚合物由X( )和Y(
)和Y( )聚合而成。
)聚合而成。
A.大于 B.等于 C.小于
2.请写出TPU中元素的第一电离能的大小关系
您最近一年使用:0次
名校
4 . 研究有机物的结构和性质对生产生活意义深远。
 .已知A-F六种有机化合物,根据要求回答问题。
.已知A-F六种有机化合物,根据要求回答问题。___________ ,B物质的分子式为:___________ 。
(2)按官能团分类,D所属的类别是___________ 。
(3)1molE与足量的金属钠反应产生___________ L氢气(标况下)。
(4)实验室制取C的化学方程式___________ 。
 .蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被
.蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被 等氧化剂氧化为脱氢维生素C.根据要求回答问题。
等氧化剂氧化为脱氢维生素C.根据要求回答问题。___________ (填名称)。
(6)脱氢维生素C中,键角①___________ 键角②(填“>”、“=”或“<”)。
(7)向碘和淀粉溶液中加入维生素C,可能观察到的现象是___________ 。
(8)标出维生素C中所有的手性碳原子(用*标注)___________ 。
 .已知A-F六种有机化合物,根据要求回答问题。
.已知A-F六种有机化合物,根据要求回答问题。A. 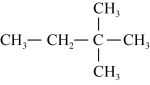 B.
B. 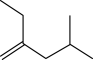 C.
C. D.
D. 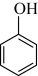 E.
E.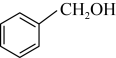
(2)按官能团分类,D所属的类别是
(3)1molE与足量的金属钠反应产生
(4)实验室制取C的化学方程式
 .蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被
.蔬菜和水果中富含维生素C,维生素C具有还原性,其又被称为抗坏血酸,在酸性溶液中可以被 等氧化剂氧化为脱氢维生素C.根据要求回答问题。
等氧化剂氧化为脱氢维生素C.根据要求回答问题。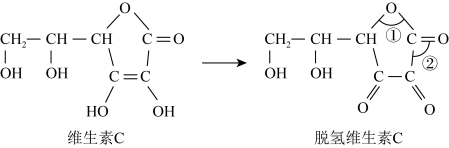
(6)脱氢维生素C中,键角①
(7)向碘和淀粉溶液中加入维生素C,可能观察到的现象是
(8)标出维生素C中所有的手性碳原子(用*标注)
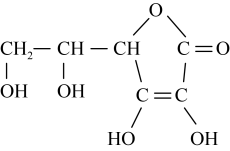
您最近一年使用:0次
解题方法
5 . 完成下列问题
(1)水分子中的共价键,依据原子轨道重叠的方式判断,属于___________ 键,水分子的VSEPR模型名称是___________ 。
(2)由铁原子形成的四种微粒,价层电子轨道表示式分别为①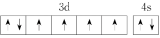 、②
、②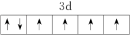 、③
、③ 、④
、④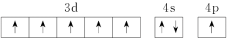 ,有关这些微粒的叙述不正确的是
,有关这些微粒的叙述不正确的是___________ (填字母)。
A.微粒半径:④>①>②
B.电离一个电子所需最低能量:②>①>④
C.微粒③价层电子在简并轨道中单独分占且自旋相同,故不能再继续失电子
(3)用“>”或“<”填空:
①沸点:邻羟基苯甲酸___________ 对羟基苯甲酸。
②pKa:CF3COOH___________ CH3COOH。
(4)填写下列物质所含官能团的名称
①CH3C≡CCH3___________ ;___________ 。
(5)下列化合物中,核磁共振氢谱只出现三组峰且峰面积之比为3:2:2的是___________。
(6)某烃的蒸气对H2的相对密度为21,该烃中碳元素的质量分数为85.7%,则该烃的分子式为___________ ,可能的结构简式为___________ 、___________ 。
(1)水分子中的共价键,依据原子轨道重叠的方式判断,属于
(2)由铁原子形成的四种微粒,价层电子轨道表示式分别为①
 、②
、② 、③
、③ 、④
、④ ,有关这些微粒的叙述不正确的是
,有关这些微粒的叙述不正确的是A.微粒半径:④>①>②
B.电离一个电子所需最低能量:②>①>④
C.微粒③价层电子在简并轨道中单独分占且自旋相同,故不能再继续失电子
(3)用“>”或“<”填空:
①沸点:邻羟基苯甲酸
②pKa:CF3COOH
(4)填写下列物质所含官能团的名称
①CH3C≡CCH3
②
(5)下列化合物中,核磁共振氢谱只出现三组峰且峰面积之比为3:2:2的是___________。
| A.(CH3)2CHCH(CH3)2 | B.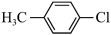 |
C.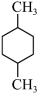 | D.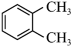 |
您最近一年使用:0次
6 . 黄铜矿(CuFeS2)是工业炼铜,炼铁和制硫酸的重要原料。回答下列问题:
(1)铜元素位于元素周期表___________ 区,基态Fe2+的价层电子排布图(轨道表示式)是___________ 。
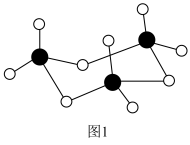
(2)气态SO3以单分子形式存在,其分子的空间结构为___________ 。固体:SO3中存在如图1所示的三聚分子,该分子中S原子的杂化轨道类型为___________ 。___________ 。
②该配离子中H—O—H的键角___________ (填“大于”、“小于”或“等于”)单个水分子中H—O——H的键角。
(4)①改性Fe3O4是一种优良的磁性材料,Fe3O4晶胞的 的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是
的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是___________ (填“a”或“b”或“c”)。
②普鲁士蓝晶体属于立方晶系,晶胞结构如图4所示(CN⁻在图中省略),该晶体的化学式为___________ 。
(1)铜元素位于元素周期表
(2)气态SO3以单分子形式存在,其分子的空间结构为

②该配离子中H—O—H的键角
(4)①改性Fe3O4是一种优良的磁性材料,Fe3O4晶胞的
 的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是
的结构如图3所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+在晶胞中的位置是②普鲁士蓝晶体属于立方晶系,晶胞结构如图4所示(CN⁻在图中省略),该晶体的化学式为

您最近一年使用:0次
2024-05-08更新
|
283次组卷
|
2卷引用:2024届内蒙古自治区赤峰市高三下学期三模理科综合试题-高中化学
7 . 用“>”或“<”填空。
(1)比较键长大小:①C—H___________ N—H___________ H—O;
(2)比较键能大小:C—H___________ N—H___________ H—O。
(3)比较键角大小:①CO2___________ NH3.
(1)比较键长大小:①C—H
(2)比较键能大小:C—H
(3)比较键角大小:①CO2
您最近一年使用:0次
名校
8 . 卤素单质及其化合物在工农业生产中有着广泛的应用。回答下列问题:
(1)类卤素 对应的酸有两种,硫氰酸(
对应的酸有两种,硫氰酸( )和异硫氰酸(
)和异硫氰酸( ):
):
①硫氰酸和异硫氰酸分子中 键和
键和 键个数之比
键个数之比___________ (填“相等”或“不相等”)。
②异硫氰酸中N的杂化轨道类型是___________ 。
③硫氰酸的电子式为___________ 。
(2) 的VSEPR模型是
的VSEPR模型是___________ , 的中心原子的价层电子对数是
的中心原子的价层电子对数是___________ 。
(3)键角:
___________ (填“>”“<”或“=”) ,判断的理由为
,判断的理由为___________ 。
(4)酸性:三氟乙酸( )
)___________ (填“>”或“<”) ,判断的理由为
,判断的理由为___________ 。
(5) 与水反应的化学方程式为
与水反应的化学方程式为___________ (该反应为非氧化还原反应)。
(1)类卤素
 对应的酸有两种,硫氰酸(
对应的酸有两种,硫氰酸( )和异硫氰酸(
)和异硫氰酸( ):
):①硫氰酸和异硫氰酸分子中
 键和
键和 键个数之比
键个数之比②异硫氰酸中N的杂化轨道类型是
③硫氰酸的电子式为
(2)
 的VSEPR模型是
的VSEPR模型是 的中心原子的价层电子对数是
的中心原子的价层电子对数是(3)键角:

 ,判断的理由为
,判断的理由为(4)酸性:三氟乙酸(
 )
) ,判断的理由为
,判断的理由为(5)
 与水反应的化学方程式为
与水反应的化学方程式为
您最近一年使用:0次
2024-04-26更新
|
208次组卷
|
2卷引用:广西壮族自治区桂林市联考2023-2024学年高二下学期3月月考化学试题
9 . I.按构成晶体的粒子和粒子间作用力的不同,将以下晶体进行分类:
①氯化钡、②石英、③金刚砂、④水、⑤乙醇、⑥铜、⑦氯酸钾、⑧高锰酸钾、⑨稀有气体的晶体、⑩干冰
(1)属于共价晶体的有:___________ ;属于分子晶体的有:___________ ;属于离子晶体的有:___________ ;属于金属晶体的有:___________ 。
Ⅱ.比较:
(2)熔点:金刚石___________ 干冰(填“>”或“<”),原因是___________ 。
(3)键角:CH4___________ H2O(填“>”或“<”),原因是___________ 。
Ⅲ.请回答:
(4)黄铜合金采取面心立方堆积,其晶胞结构如图所示:___________ 。
②与Cu原子等距离且最近的Cu原子有___________ 个。
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:___________ 。
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图。___________ 。
①氯化钡、②石英、③金刚砂、④水、⑤乙醇、⑥铜、⑦氯酸钾、⑧高锰酸钾、⑨稀有气体的晶体、⑩干冰
(1)属于共价晶体的有:
Ⅱ.比较:
(2)熔点:金刚石
(3)键角:CH4
Ⅲ.请回答:
(4)黄铜合金采取面心立方堆积,其晶胞结构如图所示:

②与Cu原子等距离且最近的Cu原子有
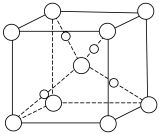
(5)甲醛与新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:
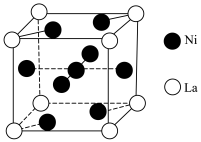
(6)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图。
您最近一年使用:0次
名校
10 . 三磷酸腺苷(ATP)和活性氧类(如H2O2和 )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。
(1)ATP的分子式为C10H16N5O13P3,其中电负性最大的元素基态原子的核外电子排布式是________ ,基态N原子的电子排布图为________ 。
(2)对H2O2分子结构的研究,H2O2分子的电子式为:________ ,其中氧原子的杂化轨道类型为:________ ;为确定其空间结构不是直线形分子,应测定H2O2分子中________ (填字母序号)
a. 键长 b.
键长 b. 键能 c.
键能 c. 键角
键角
(3)H2O2是一种绿色氧化剂有广泛应用,写出Cu、稀硫酸与H2O2反应制备硫酸铜的离子方程式:_________ 。
(4)O3分子的空间结构为V形,O3分子是________ 分子(填“极性”或“非极性”)。
 )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。(1)ATP的分子式为C10H16N5O13P3,其中电负性最大的元素基态原子的核外电子排布式是
(2)对H2O2分子结构的研究,H2O2分子的电子式为:
a.
 键长 b.
键长 b. 键能 c.
键能 c. 键角
键角(3)H2O2是一种绿色氧化剂有广泛应用,写出Cu、稀硫酸与H2O2反应制备硫酸铜的离子方程式:
(4)O3分子的空间结构为V形,O3分子是
您最近一年使用:0次



