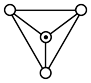
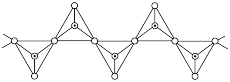
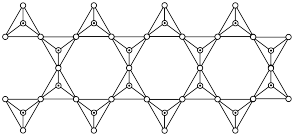
解题方法
1 . 乙醚是一种极易挥发的无色透明液体。乙醚长时间与空气接触时,逐渐生成过氧化乙醚( )。
)。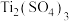 、
、 、
、 可除去过氧化乙醚。回答下列问题:
可除去过氧化乙醚。回答下列问题:
(1)基态 、O、
、O、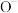 的第一电离能
的第一电离能 按由大到小排序为
按由大到小排序为___________ 。
(2)基态 还原过氧化乙醚时失去的是
还原过氧化乙醚时失去的是___________ 轨道电子,从电负性角度判断 中H的化合价为
中H的化合价为___________ 。 中
中 键的化学键类型为
键的化学键类型为___________ ,中心原子的杂化轨道类型为___________ 。
(3)一个过氧化乙醚分子中,价层电子对数目为4的原子有___________ 个。过氧化乙醚分子中的键能如下:
造成 键键能小于
键键能小于 键键能的可能原因是
键键能的可能原因是___________ 。
(4)乙醚沸点35.6℃,丙酸( )沸点为141℃,两者沸点差异较大的主要原因是
)沸点为141℃,两者沸点差异较大的主要原因是___________ 。
(5)硫酸亚铁的正交晶胞参数为 、
、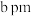 、
、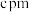 ,
,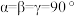 ,晶胞沿c轴、a轴的投影图见下,假设阿伏加德罗常数的值为
,晶胞沿c轴、a轴的投影图见下,假设阿伏加德罗常数的值为 。
。___________  ,晶体密度为
,晶体密度为___________  (列出算式)。
(列出算式)。
 )。
)。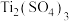 、
、 、
、 可除去过氧化乙醚。回答下列问题:
可除去过氧化乙醚。回答下列问题:(1)基态
 、O、
、O、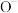 的第一电离能
的第一电离能 按由大到小排序为
按由大到小排序为(2)基态
 还原过氧化乙醚时失去的是
还原过氧化乙醚时失去的是 中H的化合价为
中H的化合价为 中
中 键的化学键类型为
键的化学键类型为(3)一个过氧化乙醚分子中,价层电子对数目为4的原子有
| 单键 |  |  |  |  |  |
键能/( ) ) | 346 | 411 | 358 | 207 | 459 |
 键键能小于
键键能小于 键键能的可能原因是
键键能的可能原因是(4)乙醚沸点35.6℃,丙酸(
 )沸点为141℃,两者沸点差异较大的主要原因是
)沸点为141℃,两者沸点差异较大的主要原因是(5)硫酸亚铁的正交晶胞参数为
 、
、 、
、 ,
,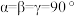 ,晶胞沿c轴、a轴的投影图见下,假设阿伏加德罗常数的值为
,晶胞沿c轴、a轴的投影图见下,假设阿伏加德罗常数的值为 。
。
 ,晶体密度为
,晶体密度为 (列出算式)。
(列出算式)。
您最近半年使用:0次
名校
解题方法
2 . 氮族元素可以形成多种多样的化合物,回答下列问题:
(1)基态As原子的价电子的轨道表示式是______ 。
(2)叠氮酸(HN3)常用于引爆剂,可用联氨( )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
______ 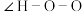 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: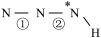 ,
, 为
为 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①______ ②。
(3)乙胺( )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是______ 。
(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是______ 。

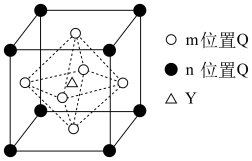
(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为 ,晶胞参数为
,晶胞参数为 ,
, 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是______ ,n原子的分数坐标是______ ,若阿伏加德罗常数值为 ,该晶体密度是
,该晶体密度是______  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态As原子的价电子的轨道表示式是
(2)叠氮酸(HN3)常用于引爆剂,可用联氨(
 )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
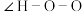 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: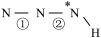 ,
, 为
为 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①(3)乙胺(
 )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为
 ,晶胞参数为
,晶胞参数为 ,
, 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是 ,该晶体密度是
,该晶体密度是 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
3 . 硼是第ⅢA族中唯一的非金属元素,可以形成众多的化合物。回答下列问题:
(1)硼烷泛指一切硼和氢组成的化合物。乙硼烷( )是最简单的硼烷,可以在
)是最简单的硼烷,可以在_______ (填“乙酸”或“乙醚”或“水”)介质中使用 还原
还原 获得,
获得, 的电子式为
的电子式为_______ ,制备乙硼烷的化学方程式为_______ 。 )的溶解度
)的溶解度
(2)操作1是蒸发浓缩、冷却结晶、过滤、_______ ,干燥;整个流程中可循环利用的物质是_______ 。
(3)硼酸( )是一元弱酸,在溶液中存在平衡:
)是一元弱酸,在溶液中存在平衡: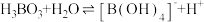 (常温下:
(常温下: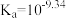 ),
), 与NaOH溶液反应可制备硼砂。常温下,在
与NaOH溶液反应可制备硼砂。常温下,在 硼砂溶液中,
硼砂溶液中,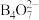 水解生成等物质的量浓度的
水解生成等物质的量浓度的 和
和 ,该溶液pH=
,该溶液pH=_______ 。常温常压下,硼酸( )晶体结构为层状,其二维平面结构如图所示:
)晶体结构为层状,其二维平面结构如图所示:_______ 。
(4)相关化学键的键能如下表所示,简要分析和解释下列事实。
自然界中不存在硼单质,硼氢化物也很少,主要是含氧化合物,其原因为_______ 。
(1)硼烷泛指一切硼和氢组成的化合物。乙硼烷(
 )是最简单的硼烷,可以在
)是最简单的硼烷,可以在 还原
还原 获得,
获得, 的电子式为
的电子式为
 )的溶解度
)的溶解度| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 80 |
| 溶解度/g | 2.77 | 3.65 | 4.87 | 6.77 | 8.90 | 23.54 |
(2)操作1是蒸发浓缩、冷却结晶、过滤、
(3)硼酸(
 )是一元弱酸,在溶液中存在平衡:
)是一元弱酸,在溶液中存在平衡: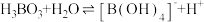 (常温下:
(常温下: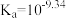 ),
), 与NaOH溶液反应可制备硼砂。常温下,在
与NaOH溶液反应可制备硼砂。常温下,在 硼砂溶液中,
硼砂溶液中,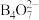 水解生成等物质的量浓度的
水解生成等物质的量浓度的 和
和 ,该溶液pH=
,该溶液pH= )晶体结构为层状,其二维平面结构如图所示:
)晶体结构为层状,其二维平面结构如图所示: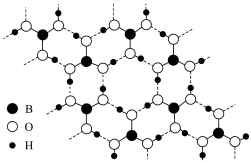
H3BO3的层状结构
从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大的原因:(4)相关化学键的键能如下表所示,简要分析和解释下列事实。
| 化学键 |  |  |  |
键能( ) ) | 389 | 561 | 293 |
您最近半年使用:0次
4 . 化合物T是一种用于合成药物的重要试剂,其结构如图所示。已知X、Y、Z、M、N为原子序数依次增大的前20号主族元素,元素X的核外电子数等于周期数,Y的基态原子最外层有2个未成对电子,Z、M位于同一主族,基态M原子3p轨道上有4个电子。______ (写元素符号)。
(2)Z、M、N的原子半径由大到小的顺序为______ (写元素符号)。
(3) 分子中σ键和π键的数目之比为
分子中σ键和π键的数目之比为_______ , 属于
属于_____ (填“极性”或“非极性”)分子。
(4) 的中心原子的杂化类型为
的中心原子的杂化类型为______ ,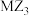 的空间结构为
的空间结构为________ 。
(5) 分子的中心原子孤电子对数为
分子的中心原子孤电子对数为________ , 中
中 键角比)
键角比) 中
中 键角小的原因是
键角小的原因是________ 。
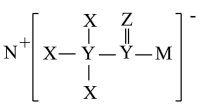
(2)Z、M、N的原子半径由大到小的顺序为
(3)
 分子中σ键和π键的数目之比为
分子中σ键和π键的数目之比为 属于
属于(4)
 的中心原子的杂化类型为
的中心原子的杂化类型为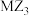 的空间结构为
的空间结构为(5)
 分子的中心原子孤电子对数为
分子的中心原子孤电子对数为 中
中 键角比)
键角比) 中
中 键角小的原因是
键角小的原因是
您最近半年使用:0次
名校
解题方法
5 . 前四周期原子序数依次增大的元素 、
、 、
、 、
、 、
、 、
、 ,
, 中,
中, 的核外电子只有一个;
的核外电子只有一个; 的价电子层中未成对电子只有2个,且
的价电子层中未成对电子只有2个,且 紧邻
紧邻 ;
; 和
和 的价电子层中未成对电子均只有1个,并且
的价电子层中未成对电子均只有1个,并且 和
和 的电子数相差8;与
的电子数相差8;与 位于同一周期的
位于同一周期的 和
和 ,它们价电子层中的未成对电子数分别为4和2,且原子序数相差2.回答下列问题:
,它们价电子层中的未成对电子数分别为4和2,且原子序数相差2.回答下列问题:
(1)实验室常用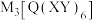 检验
检验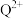 ,反应的离子方程式为
,反应的离子方程式为 。
。
①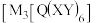 中
中 离子的配位数为
离子的配位数为_______ 。
②形成配位键时, 中提供孤电子对的原子为
中提供孤电子对的原子为_______ (填元素符号)。
③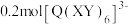 中含
中含_______  键。
键。
(2)金属 化物是应用广泛的还原剂。
化物是应用广泛的还原剂。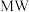 的还原性比
的还原性比 的强,原因为
的强,原因为_______ 。
(3)由 、
、 组成的化合物
组成的化合物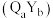 在磁记录材料领域有着广阔的应用前景。某
在磁记录材料领域有着广阔的应用前景。某 的晶胞结构如图所示(
的晶胞结构如图所示( 、
、 位置均有
位置均有 ),若立方晶胞的参数为
),若立方晶胞的参数为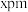 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为_______ (用含 、
、 的代数式表示)
的代数式表示) 。
。
由表中数据可得知: 和
和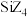 熔点相差较小,
熔点相差较小,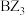 和
和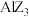 熔点相差较大。请简述
熔点相差较大。请简述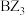 和
和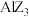 熔点相差较大的原因:
熔点相差较大的原因:_______ 。
(5) 能形成多种配合物,如
能形成多种配合物,如 :
:
① 中
中 键角比独立存在的
键角比独立存在的 分子中键角略大,原因为
分子中键角略大,原因为_______ 。
②一定条件下,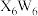 与
与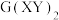 在氨水中可生成一种淡紫色
在氨水中可生成一种淡紫色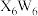 包合沉淀物。该沉淀物晶体属四方晶系,晶胞结构和晶胞参数如图所示,晶胞棱边夹角为
包合沉淀物。该沉淀物晶体属四方晶系,晶胞结构和晶胞参数如图所示,晶胞棱边夹角为 。
。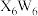 分子位于晶胞的体心且2个
分子位于晶胞的体心且2个 键平行于
键平行于 轴。已知
轴。已知 键长为
键长为 ,
, 键长为
键长为 ,则该晶体中,
,则该晶体中, 与
与 的个数之比为
的个数之比为_______ ,晶胞中 与
与 间的距离为
间的距离为_______  。
。
 、
、 、
、 、
、 、
、 、
、 ,
, 中,
中, 的核外电子只有一个;
的核外电子只有一个; 的价电子层中未成对电子只有2个,且
的价电子层中未成对电子只有2个,且 紧邻
紧邻 ;
; 和
和 的价电子层中未成对电子均只有1个,并且
的价电子层中未成对电子均只有1个,并且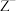 和
和 的电子数相差8;与
的电子数相差8;与 位于同一周期的
位于同一周期的 和
和 ,它们价电子层中的未成对电子数分别为4和2,且原子序数相差2.回答下列问题:
,它们价电子层中的未成对电子数分别为4和2,且原子序数相差2.回答下列问题:(1)实验室常用
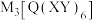 检验
检验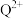 ,反应的离子方程式为
,反应的离子方程式为 。
。①
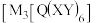 中
中 离子的配位数为
离子的配位数为②形成配位键时,
 中提供孤电子对的原子为
中提供孤电子对的原子为③
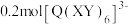 中含
中含 键。
键。(2)金属
 化物是应用广泛的还原剂。
化物是应用广泛的还原剂。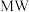 的还原性比
的还原性比 的强,原因为
的强,原因为(3)由
 、
、 组成的化合物
组成的化合物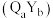 在磁记录材料领域有着广阔的应用前景。某
在磁记录材料领域有着广阔的应用前景。某 的晶胞结构如图所示(
的晶胞结构如图所示( 、
、 位置均有
位置均有 ),若立方晶胞的参数为
),若立方晶胞的参数为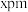 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为 、
、 的代数式表示)
的代数式表示) 。
。
| 物质 |  | 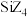 | 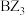 | 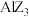 |
熔点/ |  | 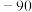 |  | 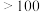 |
 和
和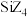 熔点相差较小,
熔点相差较小,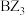 和
和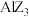 熔点相差较大。请简述
熔点相差较大。请简述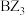 和
和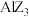 熔点相差较大的原因:
熔点相差较大的原因:(5)
 能形成多种配合物,如
能形成多种配合物,如 :
:①
 中
中 键角比独立存在的
键角比独立存在的 分子中键角略大,原因为
分子中键角略大,原因为②一定条件下,
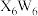 与
与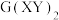 在氨水中可生成一种淡紫色
在氨水中可生成一种淡紫色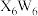 包合沉淀物。该沉淀物晶体属四方晶系,晶胞结构和晶胞参数如图所示,晶胞棱边夹角为
包合沉淀物。该沉淀物晶体属四方晶系,晶胞结构和晶胞参数如图所示,晶胞棱边夹角为 。
。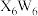 分子位于晶胞的体心且2个
分子位于晶胞的体心且2个 键平行于
键平行于 轴。已知
轴。已知 键长为
键长为 ,
, 键长为
键长为 ,则该晶体中,
,则该晶体中, 与
与 的个数之比为
的个数之比为 与
与 间的距离为
间的距离为 。
。
您最近半年使用:0次
解题方法
6 . 磷的单质及其化合物在生产、生活中具有广泛应用。回答下列问题:
(1)基态磷原子价电子排布式为___________ ,核外电子占据的最高能级的电子云轮廓图为___________ 形。
(2)第三周期元素中第一电离能介于硅和磷之间的元素为___________ (填元素符号),离子半径:
___________ (填“>”“<”或“=”) 。
。
(3) 固体属于
固体属于___________ 晶体,键能: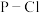
___________ (填“>”“<”或“=”) ,
, 、
、 中键角较大的是
中键角较大的是___________ 。
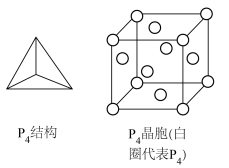
(4)白磷的分子结构及其晶胞结构如图所示,晶胞参数为 。
。 中磷原子的杂化方式为
中磷原子的杂化方式为___________ 。
②白磷晶体中,距离一个 最近的
最近的 个数为
个数为___________ 。
③该晶体的密度=___________  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)基态磷原子价电子排布式为
(2)第三周期元素中第一电离能介于硅和磷之间的元素为

 。
。(3)
 固体属于
固体属于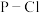
 ,
, 、
、 中键角较大的是
中键角较大的是(4)白磷的分子结构及其晶胞结构如图所示,晶胞参数为
 。
。
 中磷原子的杂化方式为
中磷原子的杂化方式为②白磷晶体中,距离一个
 最近的
最近的 个数为
个数为③该晶体的密度=
 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近半年使用:0次
7 . 硅是信息产业、太阳能电池光电转化的基础材料。
(1)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
硅与碳同族,但硅烷在种类和数量上都远不如烷烃多,原因是_______ 。
(2)锌还原四氯化硅是一种有着良好应用前景的制备硅的方法。 还原
还原 的反应如下:
的反应如下:
反应1: ,
,
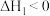
反应2: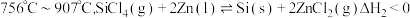
反应3: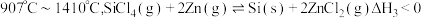
①对于上述三个反应,下列说法合理的是_______ 。
a.升高温度会提高 的转化率 b.还原过程需在无氧的气氛中进行
的转化率 b.还原过程需在无氧的气氛中进行
c.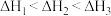 d.Na、Mg可以代替
d.Na、Mg可以代替 还原
还原
②实际制备过程选择“反应3”,选择的理由是_______ 。
(3)工业上也可用 制备高纯硅。
制备高纯硅。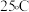 时,
时, 相关反应的热化学方程式和平衡常数如表:
相关反应的热化学方程式和平衡常数如表:
①则该温度下, =
= _______________  ;K3=
;K3=_______ (用K1和K2表示)。
②对于反应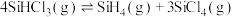 ,采用大孔弱碱性阴离子交换树脂催化剂,在
,采用大孔弱碱性阴离子交换树脂催化剂,在 和
和 时
时 的转化率随时间变化的结果如图所示。则T1
的转化率随时间变化的结果如图所示。则T1_____________ T2(填“大于”“小于”或“等于”), 时平衡常数K=
时平衡常数K=_______ (保留2位小数)。 下,要提高
下,要提高 转化率,可采取的措施是
转化率,可采取的措施是_______ 。
(1)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 |  |  |  |  |
键能 | 356 | 413 | 226 | 318 |
(2)锌还原四氯化硅是一种有着良好应用前景的制备硅的方法。
 还原
还原 的反应如下:
的反应如下:反应1:
 ,
,
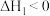
反应2:
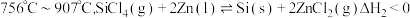
反应3:
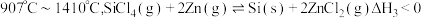
①对于上述三个反应,下列说法合理的是
a.升高温度会提高
 的转化率 b.还原过程需在无氧的气氛中进行
的转化率 b.还原过程需在无氧的气氛中进行c.
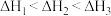 d.Na、Mg可以代替
d.Na、Mg可以代替 还原
还原
②实际制备过程选择“反应3”,选择的理由是
(3)工业上也可用
 制备高纯硅。
制备高纯硅。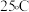 时,
时, 相关反应的热化学方程式和平衡常数如表:
相关反应的热化学方程式和平衡常数如表:| 热化学方程式 | 平衡常数 |
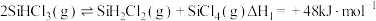 | K1 |
 | K2 |
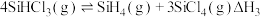 | K3 |
 =
=  ;K3=
;K3=②对于反应
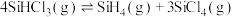 ,采用大孔弱碱性阴离子交换树脂催化剂,在
,采用大孔弱碱性阴离子交换树脂催化剂,在 和
和 时
时 的转化率随时间变化的结果如图所示。则T1
的转化率随时间变化的结果如图所示。则T1 时平衡常数K=
时平衡常数K=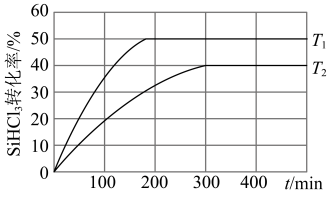
 下,要提高
下,要提高 转化率,可采取的措施是
转化率,可采取的措施是
您最近半年使用:0次
8 . 硅材料在生产、生活中占有重有地位。回答下列问题:
(1)基态 原子的电子排布式
原子的电子排布式___________ 。
(2)某含硅化合物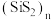 的长链状结构(片段)截取部分如图所示。该化合物的晶体类型是
的长链状结构(片段)截取部分如图所示。该化合物的晶体类型是___________ 。
(4)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中。硅酸盐中的阴离子结构丰富多样,既有有限数目的硅氧四面体构成的简单阴离子 (图a),也有以硅氧四面体结构单元构成的
(图a),也有以硅氧四面体结构单元构成的无限 延长的单链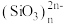 (图b)、双链(图c)等更复杂的结构。
(图b)、双链(图c)等更复杂的结构。
写出图c所示阴离子的化学式___________ 。
(5)碳和硅的有关化学键键能、键长如下所示:
硅与碳同族,也有系列含氢化合物,但硅的含氢化合物在种类和数量上都远不如碳的含氢化合物多,试从共价键的成键角度解释原因___________ 。
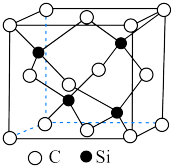
(6)已知 晶体的密度为
晶体的密度为 ,其晶胞结构如图所示。阿伏加德罗常数值为
,其晶胞结构如图所示。阿伏加德罗常数值为 ,则晶胞中两个
,则晶胞中两个 原子之间的距离为
原子之间的距离为___________  。
。
(1)基态
 原子的电子排布式
原子的电子排布式(2)某含硅化合物
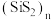 的长链状结构(片段)截取部分如图所示。该化合物的晶体类型是
的长链状结构(片段)截取部分如图所示。该化合物的晶体类型是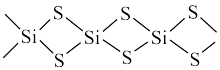
A.在晶体 和晶体 和晶体 结构中 结构中 均是 均是 杂化 杂化 |
B.常温下粗硅与盐酸反应制取 ,再以 ,再以 高温还原得到高纯硅 高温还原得到高纯硅 |
C. 比 比 易水解原因之一是 易水解原因之一是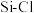 键能弱于 键能弱于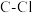 |
D. 晶体的X射线图谱显示有明锐的衍射峰 晶体的X射线图谱显示有明锐的衍射峰 |
(4)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中。硅酸盐中的阴离子结构丰富多样,既有有限数目的硅氧四面体构成的简单阴离子
 (图a),也有以硅氧四面体结构单元构成的
(图a),也有以硅氧四面体结构单元构成的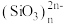 (图b)、双链(图c)等更复杂的结构。
(图b)、双链(图c)等更复杂的结构。
|
|
|
| 图a | 图b | 图c |
(5)碳和硅的有关化学键键能、键长如下所示:
| 化学键 | 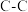 | 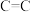 |  |  |  | 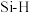 |
键能/ | 348 | 615 | 812 | 413 | 226 | 318 |
键长/ | 154 | 133 | 120 | 109 | 235 | 150 |
(6)已知
 晶体的密度为
晶体的密度为 ,其晶胞结构如图所示。阿伏加德罗常数值为
,其晶胞结构如图所示。阿伏加德罗常数值为 ,则晶胞中两个
,则晶胞中两个 原子之间的距离为
原子之间的距离为 。
。
您最近半年使用:0次
名校
9 . 按要求回答下列问题
(1) 的晶胞形状为立方体,如图所示。
的晶胞形状为立方体,如图所示。___________ 。
②该晶胞中,每个Ca周围与它最近且相等距离的O有___________ 个。
③该晶胞结构的另一种表示中,Ti处于各顶角位置,则O处于___________ 位置。
(2)镓的卤化物都有较高的催化活性,可用于聚合和脱水等工艺,查得:
① 的熔点高于
的熔点高于 ,却远低于
,却远低于 ,原因是
,原因是___________ 。
②镓,锗元素及其化合物有许多用途。比较 ,
, 的键角:Cl-Ga-Cl
的键角:Cl-Ga-Cl___________ Cl-Ge-Cl(填“>”“<”或“=”)
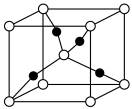
(3) 晶体的晶胞结构如图,晶胞参数为anm,
晶体的晶胞结构如图,晶胞参数为anm, 的配位数
的配位数___________ 。该晶体密度的计算表达式为
___________  。
。
(1)
 的晶胞形状为立方体,如图所示。
的晶胞形状为立方体,如图所示。
②该晶胞中,每个Ca周围与它最近且相等距离的O有
③该晶胞结构的另一种表示中,Ti处于各顶角位置,则O处于
(2)镓的卤化物都有较高的催化活性,可用于聚合和脱水等工艺,查得:
| 物质 |  |  |  |
| 熔点/℃ | 124 | 78 | 1000 |
 的熔点高于
的熔点高于 ,却远低于
,却远低于 ,原因是
,原因是②镓,锗元素及其化合物有许多用途。比较
 ,
, 的键角:Cl-Ga-Cl
的键角:Cl-Ga-Cl(3)
 晶体的晶胞结构如图,晶胞参数为anm,
晶体的晶胞结构如图,晶胞参数为anm, 的配位数
的配位数
 。
。
您最近半年使用:0次
名校
解题方法
10 . 矾是一些金属硫酸盐的统称,其中皓矾的化学式为 ,可用作媒染剂、木材防腐剂。下图是
,可用作媒染剂、木材防腐剂。下图是 的结构示意图:
的结构示意图: 离子。
离子。
1. 分子的分子构型为
分子的分子构型为___________ ,中心原子杂化方式为___________ 杂化。
2. 的沸点
的沸点___________ (填>、<或=)水的沸点,原因可能是___________ 。
3. 中,
中, 与
与 间的作用力为
间的作用力为___________ , 与
与 间的作用力为
间的作用力为___________ 。
4. 与
与 中的中心原子均为
中的中心原子均为 杂化,
杂化, 中H—O—H键角
中H—O—H键角___________ (填>、<或=) 中O—S—O键角,原因是
中O—S—O键角,原因是___________ 。
5.写出 溶于氨水的化学方程式
溶于氨水的化学方程式___________ 。
6. 受热失水时,随着温度的升高,先失去一个水分子,变为
受热失水时,随着温度的升高,先失去一个水分子,变为 ,再失去其它的水,首先失去的水分子应为
,再失去其它的水,首先失去的水分子应为___________ (填①或②),原因是___________ 。
 ,可用作媒染剂、木材防腐剂。下图是
,可用作媒染剂、木材防腐剂。下图是 的结构示意图:
的结构示意图: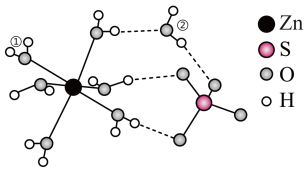
 离子。
离子。1.
 分子的分子构型为
分子的分子构型为2.
 的沸点
的沸点3.
 中,
中, 与
与 间的作用力为
间的作用力为 与
与 间的作用力为
间的作用力为4.
 与
与 中的中心原子均为
中的中心原子均为 杂化,
杂化, 中H—O—H键角
中H—O—H键角 中O—S—O键角,原因是
中O—S—O键角,原因是5.写出
 溶于氨水的化学方程式
溶于氨水的化学方程式6.
 受热失水时,随着温度的升高,先失去一个水分子,变为
受热失水时,随着温度的升高,先失去一个水分子,变为 ,再失去其它的水,首先失去的水分子应为
,再失去其它的水,首先失去的水分子应为
您最近半年使用:0次