1 . 硅材料在生产、生活中占有重有地位。回答下列问题:
(1)基态 原子的电子排布式
原子的电子排布式___________ 。
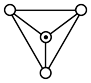
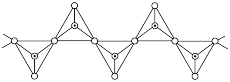
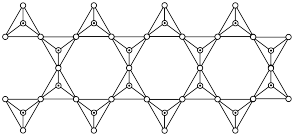
(2)某含硅化合物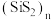 的长链状结构(片段)截取部分如图所示。该化合物的晶体类型是
的长链状结构(片段)截取部分如图所示。该化合物的晶体类型是___________ 。
(4)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中。硅酸盐中的阴离子结构丰富多样,既有有限数目的硅氧四面体构成的简单阴离子 (图a),也有以硅氧四面体结构单元构成的
(图a),也有以硅氧四面体结构单元构成的无限 延长的单链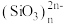 (图b)、双链(图c)等更复杂的结构。
(图b)、双链(图c)等更复杂的结构。
写出图c所示阴离子的化学式___________ 。
(5)碳和硅的有关化学键键能、键长如下所示:
硅与碳同族,也有系列含氢化合物,但硅的含氢化合物在种类和数量上都远不如碳的含氢化合物多,试从共价键的成键角度解释原因___________ 。
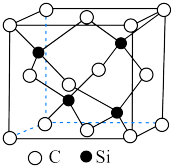
(6)已知 晶体的密度为
晶体的密度为 ,其晶胞结构如图所示。阿伏加德罗常数值为
,其晶胞结构如图所示。阿伏加德罗常数值为 ,则晶胞中两个
,则晶胞中两个 原子之间的距离为
原子之间的距离为___________  。
。
(1)基态
 原子的电子排布式
原子的电子排布式(2)某含硅化合物
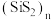 的长链状结构(片段)截取部分如图所示。该化合物的晶体类型是
的长链状结构(片段)截取部分如图所示。该化合物的晶体类型是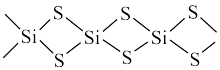
A.在晶体 和晶体 和晶体 结构中 结构中 均是 均是 杂化 杂化 |
B.常温下粗硅与盐酸反应制取 ,再以 ,再以 高温还原得到高纯硅 高温还原得到高纯硅 |
C. 比 比 易水解原因之一是 易水解原因之一是 键能弱于 键能弱于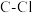 |
D. 晶体的X射线图谱显示有明锐的衍射峰 晶体的X射线图谱显示有明锐的衍射峰 |
(4)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中。硅酸盐中的阴离子结构丰富多样,既有有限数目的硅氧四面体构成的简单阴离子
 (图a),也有以硅氧四面体结构单元构成的
(图a),也有以硅氧四面体结构单元构成的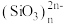 (图b)、双链(图c)等更复杂的结构。
(图b)、双链(图c)等更复杂的结构。
|
|
|
| 图a | 图b | 图c |
(5)碳和硅的有关化学键键能、键长如下所示:
| 化学键 | 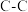 | 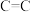 |  |  |  | 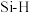 |
键能/ | 348 | 615 | 812 | 413 | 226 | 318 |
键长/ | 154 | 133 | 120 | 109 | 235 | 150 |
(6)已知
 晶体的密度为
晶体的密度为 ,其晶胞结构如图所示。阿伏加德罗常数值为
,其晶胞结构如图所示。阿伏加德罗常数值为 ,则晶胞中两个
,则晶胞中两个 原子之间的距离为
原子之间的距离为 。
。
您最近半年使用:0次
名校
解题方法
2 . 氮及其化合物应用广泛。回答下列问题:
(1)基态 原子处于最高能级的电子云轮廓图为
原子处于最高能级的电子云轮廓图为___________ 形,能量最低的激发态 的核外电子排布式为
的核外电子排布式为___________ 。
(2)胍( )为平面形分子,存在大
)为平面形分子,存在大 键
键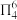 。胍属于
。胍属于___________ 分子(填“极性”或“非极性”), 原子的杂化轨道方式为
原子的杂化轨道方式为___________ ,①号 原子
原子 键角
键角___________ ②号 原子
原子 键角(填“>”“<”或“=”),胍易吸收空气中
键角(填“>”“<”或“=”),胍易吸收空气中 和
和 ,其原因是
,其原因是___________ 。
(3)氮化钴属于立方晶系,经 掺杂得催化剂
掺杂得催化剂 ,经
,经 掺杂得催化剂
掺杂得催化剂 。
。 属于立方晶系,晶胞参数为
属于立方晶系,晶胞参数为 ,距离最近
,距离最近 原子的核间距为
原子的核间距为___________  ,若
,若 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, 的密度为
的密度为___________  (用含
(用含 的代数式表示)。
的代数式表示)。 属于六方晶系,晶胞参数为
属于六方晶系,晶胞参数为 ,
, ,
,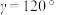 (
( 轴与
轴与 轴夹角),1个
轴夹角),1个 原子周围距离相等且最近的
原子周围距离相等且最近的 原子数目为
原子数目为___________ 。
(1)基态
 原子处于最高能级的电子云轮廓图为
原子处于最高能级的电子云轮廓图为 的核外电子排布式为
的核外电子排布式为(2)胍(
 )为平面形分子,存在大
)为平面形分子,存在大 键
键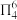 。胍属于
。胍属于 原子的杂化轨道方式为
原子的杂化轨道方式为 原子
原子 键角
键角 原子
原子 键角(填“>”“<”或“=”),胍易吸收空气中
键角(填“>”“<”或“=”),胍易吸收空气中 和
和 ,其原因是
,其原因是(3)氮化钴属于立方晶系,经
 掺杂得催化剂
掺杂得催化剂 ,经
,经 掺杂得催化剂
掺杂得催化剂 。
。
 属于立方晶系,晶胞参数为
属于立方晶系,晶胞参数为 ,距离最近
,距离最近 原子的核间距为
原子的核间距为 ,若
,若 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, 的密度为
的密度为 (用含
(用含 的代数式表示)。
的代数式表示)。 属于六方晶系,晶胞参数为
属于六方晶系,晶胞参数为 ,
, ,
,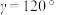 (
( 轴与
轴与 轴夹角),1个
轴夹角),1个 原子周围距离相等且最近的
原子周围距离相等且最近的 原子数目为
原子数目为
您最近半年使用:0次
名校
3 . 按要求回答下列问题:
(1)请将下列几组物质的编号填写在空格上:①D与T ②金刚石与C60 ③CH2=CHCH3和CH2=CH2④CH4和CH3CH2CH3 ⑤CH3CH2CH(CH3)2和CH3(CH2)3CH3 ⑥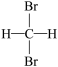 和
和 。互为同位素的是
。互为同位素的是_______ ;互为同系物的是_______ ;互为同分异构体的是_______ 。
前四周期元素A、B、M、D、E原子序数依次增大,其相关性质如表所示:
请根据以上情况,回答下列问题:
(2)A元素在周期表中的位置为____________ ,位于元素周期表的____ 区,其最高价氧化物对应水化物的阴离子的空间构型为____________ 。
(3)D的基态原子的电子占据的最高能层符号为____ ,最高能级的电子云形状为____________ 。
(4)ABD三种元素第一电离能由小到大的顺序为________________ (用元素符号表示)。BMD三种元素的简单离子的半径由大到小的顺序为________________ (用离子符号表示)。
(5)A和B形成的简单氢化物中,键角较大的是________ (填化学式),原因是________________ 。
(6)E的基态原子核外有____ 种运动状态不同的电子,该原子的简化电子排布式为_________________ 。
(1)请将下列几组物质的编号填写在空格上:①D与T ②金刚石与C60 ③CH2=CHCH3和CH2=CH2④CH4和CH3CH2CH3 ⑤CH3CH2CH(CH3)2和CH3(CH2)3CH3 ⑥
 和
和 。互为同位素的是
。互为同位素的是前四周期元素A、B、M、D、E原子序数依次增大,其相关性质如表所示:
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| M | 前三周期元素中,M元素电负性最小 |
| D | 其基态原子的价层电子排布式为nsn-1npn+1 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
(2)A元素在周期表中的位置为
(3)D的基态原子的电子占据的最高能层符号为
(4)ABD三种元素第一电离能由小到大的顺序为
(5)A和B形成的简单氢化物中,键角较大的是
(6)E的基态原子核外有
您最近半年使用:0次
名校
4 . I.金属催化剂M(Co、Ni)催化硼氢化钠( )水解释放
)水解释放 机理如下图所示:
机理如下图所示:

(1)过程Ⅱ中形成化学键的类型有________(填序号)。
(2) 最终会转化为
最终会转化为 ,1个
,1个 中存在
中存在________ 个配位键。
(3) 是一种重要的还原剂,其组成元素的电负性由大到小的顺序为
是一种重要的还原剂,其组成元素的电负性由大到小的顺序为________ 。
Ⅱ.过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为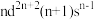 ,中子数为31,
,中子数为31,
(4)Q原子符号为________ ;基态Q原子核外成对电子数和未成对电子数之比为________ 。
Ⅲ. 、
、 是新型磁性材料的成分。依据其中有关元素回答问题:
是新型磁性材料的成分。依据其中有关元素回答问题:
(5)钕(Nd)属于镧系元素,则其在元素周期表中处于________ 区,Co元素在元素周期表中的位置________ 。
Ⅳ.分子式为 的化合物的结构如图,
的化合物的结构如图,
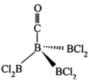
(6)其中B原子的杂化类型是________ ,B-B-B键的键角________ Cl-B-Cl的键角(填“ ”“
”“ ”或“
”或“ ”)。
”)。
 )水解释放
)水解释放 机理如下图所示:
机理如下图所示:
(1)过程Ⅱ中形成化学键的类型有________(填序号)。
| A.离子键 | B.金属键 | C.极性键 | D.非极性键 |
(2)
 最终会转化为
最终会转化为 ,1个
,1个 中存在
中存在(3)
 是一种重要的还原剂,其组成元素的电负性由大到小的顺序为
是一种重要的还原剂,其组成元素的电负性由大到小的顺序为Ⅱ.过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为
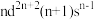 ,中子数为31,
,中子数为31,(4)Q原子符号为
Ⅲ.
 、
、 是新型磁性材料的成分。依据其中有关元素回答问题:
是新型磁性材料的成分。依据其中有关元素回答问题:(5)钕(Nd)属于镧系元素,则其在元素周期表中处于
Ⅳ.分子式为
 的化合物的结构如图,
的化合物的结构如图,
(6)其中B原子的杂化类型是
 ”“
”“ ”或“
”或“ ”)。
”)。
您最近半年使用:0次
名校
5 . 按要求回答下列问题
(1) 的晶胞形状为立方体,如图所示。
的晶胞形状为立方体,如图所示。___________ 。
②该晶胞中,每个Ca周围与它最近且相等距离的O有___________ 个。
③该晶胞结构的另一种表示中,Ti处于各顶角位置,则O处于___________ 位置。
(2)镓的卤化物都有较高的催化活性,可用于聚合和脱水等工艺,查得:
① 的熔点高于
的熔点高于 ,却远低于
,却远低于 ,原因是
,原因是___________ 。
②镓,锗元素及其化合物有许多用途。比较 ,
, 的键角:Cl-Ga-Cl
的键角:Cl-Ga-Cl___________ Cl-Ge-Cl(填“>”“<”或“=”)
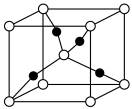
(3) 晶体的晶胞结构如图,晶胞参数为anm,
晶体的晶胞结构如图,晶胞参数为anm, 的配位数
的配位数___________ 。该晶体密度的计算表达式为
___________  。
。
(1)
 的晶胞形状为立方体,如图所示。
的晶胞形状为立方体,如图所示。
②该晶胞中,每个Ca周围与它最近且相等距离的O有
③该晶胞结构的另一种表示中,Ti处于各顶角位置,则O处于
(2)镓的卤化物都有较高的催化活性,可用于聚合和脱水等工艺,查得:
| 物质 |  |  |  |
| 熔点/℃ | 124 | 78 | 1000 |
 的熔点高于
的熔点高于 ,却远低于
,却远低于 ,原因是
,原因是②镓,锗元素及其化合物有许多用途。比较
 ,
, 的键角:Cl-Ga-Cl
的键角:Cl-Ga-Cl(3)
 晶体的晶胞结构如图,晶胞参数为anm,
晶体的晶胞结构如图,晶胞参数为anm, 的配位数
的配位数
 。
。
您最近半年使用:0次
解题方法
6 . 已知  和
和 可以形成
可以形成  和
和  两种化合物,试根据有关信息完成下列问题:
两种化合物,试根据有关信息完成下列问题:
① 内的
内的 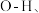 水分子间的范德华力和氢键,从强到弱依次为
水分子间的范德华力和氢键,从强到弱依次为___________ ;
②用球棍模型表示的水分子结构是 ; 可与
可与  形成
形成 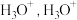 中的
中的 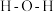 键角比
键角比  的键角
的键角___________ 。(填“大”或“小”)
(2)已知 分子的结构如图所示:
分子的结构如图所示: 分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角
分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角 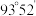 ,而两个
,而两个  键与
键与  键的夹角均为
键的夹角均为 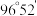 。
。
请回答下列问题:
① 子的电子式是
子的电子式是___________ ,结构式是___________ 。
② 分子是含有
分子是含有___________ 键和___________ 键的___________ (填“极性”或“非极性”)分子。
③ 能与水混溶,却不溶于
能与水混溶,却不溶于  试剂,请予以解释:
试剂,请予以解释:___________ 。
 和
和 可以形成
可以形成  和
和  两种化合物,试根据有关信息完成下列问题:
两种化合物,试根据有关信息完成下列问题:
①
 内的
内的  水分子间的范德华力和氢键,从强到弱依次为
水分子间的范德华力和氢键,从强到弱依次为②用球棍模型表示的水分子结构是 ;
A.  B.
B. 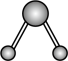 C.
C.  D.
D.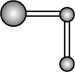
 可与
可与  形成
形成 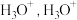 中的
中的 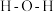 键角比
键角比  的键角
的键角(2)已知
 分子的结构如图所示:
分子的结构如图所示: 分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角
分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角 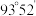 ,而两个
,而两个  键与
键与  键的夹角均为
键的夹角均为 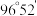 。
。请回答下列问题:
①
 子的电子式是
子的电子式是②
 分子是含有
分子是含有③
 能与水混溶,却不溶于
能与水混溶,却不溶于  试剂,请予以解释:
试剂,请予以解释:
您最近半年使用:0次
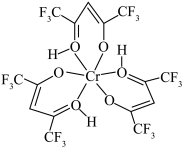
7 . 铬元素是哺乳类代谢过程中必须的微量元素,目前六氟代乙酰丙酮铬(Ⅲ)螯合物(其结构如图)的检出极限已达到3×10-12 g。回答下列问题:___________ ,H、C、O、F的电负性由大到小的顺序为___________ 。
(2)Cr3+的未成对电子数有______ 个,与Cr3+的未成对电子数相同且处于同周期的主族元素在周期表中的位置是____________ 。
(3)六氟代乙酰丙酮铬(Ⅲ)螯合物中含有的化学键有___________ 。
a.极性共价键 b.非极性共价键 c.离子键
(4)六氟代乙酰丙酮(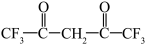 )中
)中 键有
键有______ 个。
(5)分子H2O、NH3、CH4中键角由大到小的顺序是_____________ 。
(2)Cr3+的未成对电子数有
(3)六氟代乙酰丙酮铬(Ⅲ)螯合物中含有的化学键有
a.极性共价键 b.非极性共价键 c.离子键
(4)六氟代乙酰丙酮(
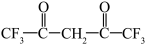 )中
)中 键有
键有(5)分子H2O、NH3、CH4中键角由大到小的顺序是
您最近半年使用:0次
解题方法
8 . 氟在已知元素中电负性最大、非金属性最强,其单质在1886年才被首次分离出来。
(1)基态F原子的核外电子排布式为___________ 。基态F原子的电子有___________ 种空间运动状态。
(2)氟氧化物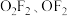 的结构已经确定。
的结构已经确定。
①依据上表数据推测 键的稳定性:
键的稳定性:
___________  (填“>”或“<”)。
(填“>”或“<”)。
② 中
中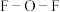 的键角小于
的键角小于 中
中 的键角,解释原因:
的键角,解释原因:___________ 。
(3) 是一种有特殊性质的氢化物。
是一种有特殊性质的氢化物。
①已知:氢键 中三原子在一条直线上时,作用力最强。测定结果表明,
中三原子在一条直线上时,作用力最强。测定结果表明,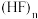 固体中
固体中 分子排列成锯齿形。画出含2个
分子排列成锯齿形。画出含2个 的重复单元结构:
的重复单元结构:___________ 。
② 中加入
中加入 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:___________ 。
(4)工业上用蒬石(主要成分 )制备
)制备 。
。 晶体的一种立方晶胞如图所示。
晶体的一种立方晶胞如图所示。 晶体中距离
晶体中距离 最近的
最近的 有
有___________ 个。
②晶体中 与
与 的最近距离为
的最近距离为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。该晶体的密度
。该晶体的密度
___________  (列出计算式)。
(列出计算式)。
(1)基态F原子的核外电子排布式为
(2)氟氧化物
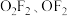 的结构已经确定。
的结构已经确定。 |  | |
 键长/pm 键长/pm | 121 | 148 |
 键的稳定性:
键的稳定性:
 (填“>”或“<”)。
(填“>”或“<”)。②
 中
中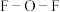 的键角小于
的键角小于 中
中 的键角,解释原因:
的键角,解释原因:(3)
 是一种有特殊性质的氢化物。
是一种有特殊性质的氢化物。①已知:氢键
 中三原子在一条直线上时,作用力最强。测定结果表明,
中三原子在一条直线上时,作用力最强。测定结果表明,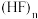 固体中
固体中 分子排列成锯齿形。画出含2个
分子排列成锯齿形。画出含2个 的重复单元结构:
的重复单元结构:②
 中加入
中加入 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:(4)工业上用蒬石(主要成分
 )制备
)制备 。
。 晶体的一种立方晶胞如图所示。
晶体的一种立方晶胞如图所示。
 晶体中距离
晶体中距离 最近的
最近的 有
有②晶体中
 与
与 的最近距离为
的最近距离为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。该晶体的密度
。该晶体的密度
 (列出计算式)。
(列出计算式)。
您最近半年使用:0次
名校
解题方法
9 . 分子人工光合作用的光捕获原理如图所示,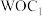 是水氧化催化剂WOC在水氧化过程中产生的中间体,
是水氧化催化剂WOC在水氧化过程中产生的中间体,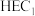 是析氢催化剂HEC在析氢过程中产生的中间体。
是析氢催化剂HEC在析氢过程中产生的中间体。
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有___________ 种,下列状态的铁中,电离最外层一个电子所需能量最大的是___________ (填选项)。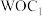 中通过螯合作用形成的配位键有
中通过螯合作用形成的配位键有___________ mol。
(3)在多原子分子中有相互平行的p轨道,它们连贯、重叠在一起,构成一个整体,p电子在多个原子间运动,像这样不局限在两个原子之间的 键称为离域
键称为离域 键,如苯分子中的离域
键,如苯分子中的离域 键可表示为
键可表示为 。N元素形成的两种微粒
。N元素形成的两种微粒 、
、 中,
中, 中的离域
中的离域 键可表示为
键可表示为___________ , 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为_________________________________ 。
(4)水催化氧化是“分子人工光合作用”的关键步骤。水的晶体有普通冰和重冰等不同类型。普通冰的晶胞结构与水分子间的氢键如图甲、乙所示。晶胞参数分别为a pm、c pm,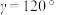 ;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。
;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。___________ pm。
②普通冰晶体的密度为______________________  (列出数学表达式,不必计算出结果)。
(列出数学表达式,不必计算出结果)。
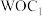 是水氧化催化剂WOC在水氧化过程中产生的中间体,
是水氧化催化剂WOC在水氧化过程中产生的中间体,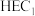 是析氢催化剂HEC在析氢过程中产生的中间体。
是析氢催化剂HEC在析氢过程中产生的中间体。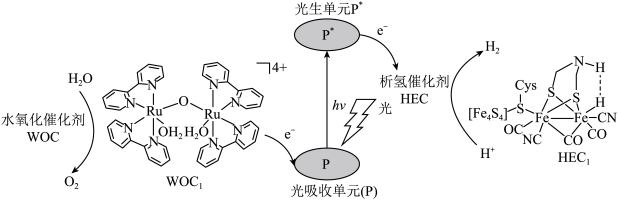
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有
A. 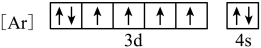
B.
C. 
D.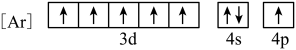
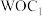 中通过螯合作用形成的配位键有
中通过螯合作用形成的配位键有(3)在多原子分子中有相互平行的p轨道,它们连贯、重叠在一起,构成一个整体,p电子在多个原子间运动,像这样不局限在两个原子之间的
 键称为离域
键称为离域 键,如苯分子中的离域
键,如苯分子中的离域 键可表示为
键可表示为 。N元素形成的两种微粒
。N元素形成的两种微粒 、
、 中,
中, 中的离域
中的离域 键可表示为
键可表示为 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为(4)水催化氧化是“分子人工光合作用”的关键步骤。水的晶体有普通冰和重冰等不同类型。普通冰的晶胞结构与水分子间的氢键如图甲、乙所示。晶胞参数分别为a pm、c pm,
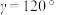 ;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。
;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。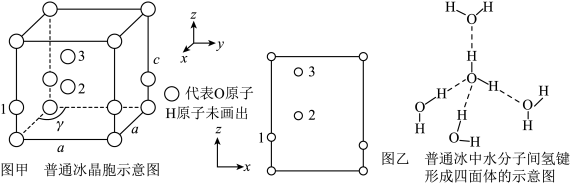
②普通冰晶体的密度为
 (列出数学表达式,不必计算出结果)。
(列出数学表达式,不必计算出结果)。
您最近半年使用:0次
名校
10 . 某原科经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
请回答下列问题:(用A、B、C、D、E所对应的元素符号作答)
(1)E的二价离子的电子排布式为___________ ;E位于元素周期表的___________ 。
(2)A2B2D4常用作除锈剂,1mol A2B2D4分子中含有σ键数目为___________ ,用质谱法测得该物质的最大质荷比为___________ 。
(3)元素As与C同族。推测As的氢化物 的空间构型
的空间构型___________ ;C元素的氢化物的键角___________  的键角(填>,<或=,下同),原因是
的键角(填>,<或=,下同),原因是___________ ;在水中溶解度:CH3___________ AsH3,原因是___________ 。
(4)S元素与D同族, 的一种三聚体环状结构如图所示,该结构中
的一种三聚体环状结构如图所示,该结构中 键长有两类,一类键长约140pm,另一类键长约为169pm,较长的键为
键长有两类,一类键长约140pm,另一类键长约为169pm,较长的键为___________ (填a或b)。
| 元素性质或原子结构 | |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
| C | 最外层P轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
(1)E的二价离子的电子排布式为
(2)A2B2D4常用作除锈剂,1mol A2B2D4分子中含有σ键数目为
(3)元素As与C同族。推测As的氢化物
 的空间构型
的空间构型 的键角(填>,<或=,下同),原因是
的键角(填>,<或=,下同),原因是(4)S元素与D同族,
 的一种三聚体环状结构如图所示,该结构中
的一种三聚体环状结构如图所示,该结构中 键长有两类,一类键长约140pm,另一类键长约为169pm,较长的键为
键长有两类,一类键长约140pm,另一类键长约为169pm,较长的键为
您最近半年使用:0次