解题方法
1 . 氟在已知元素中电负性最大、非金属性最强,其单质在1886年才被首次分离出来。
(1)基态F原子的核外电子排布式为___________ 。基态F原子的电子有___________ 种空间运动状态。
(2)氟氧化物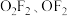 的结构已经确定。
的结构已经确定。
①依据上表数据推测 键的稳定性:
键的稳定性:
___________  (填“>”或“<”)。
(填“>”或“<”)。
② 中
中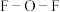 的键角小于
的键角小于 中
中 的键角,解释原因:
的键角,解释原因:___________ 。
(3) 是一种有特殊性质的氢化物。
是一种有特殊性质的氢化物。
①已知:氢键 中三原子在一条直线上时,作用力最强。测定结果表明,
中三原子在一条直线上时,作用力最强。测定结果表明,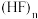 固体中
固体中 分子排列成锯齿形。画出含2个
分子排列成锯齿形。画出含2个 的重复单元结构:
的重复单元结构:___________ 。
② 中加入
中加入 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:___________ 。
(4)工业上用蒬石(主要成分 )制备
)制备 。
。 晶体的一种立方晶胞如图所示。
晶体的一种立方晶胞如图所示。 晶体中距离
晶体中距离 最近的
最近的 有
有___________ 个。
②晶体中 与
与 的最近距离为
的最近距离为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。该晶体的密度
。该晶体的密度
___________  (列出计算式)。
(列出计算式)。
(1)基态F原子的核外电子排布式为
(2)氟氧化物
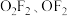 的结构已经确定。
的结构已经确定。 |  | |
 键长/pm 键长/pm | 121 | 148 |
 键的稳定性:
键的稳定性:
 (填“>”或“<”)。
(填“>”或“<”)。②
 中
中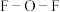 的键角小于
的键角小于 中
中 的键角,解释原因:
的键角,解释原因:(3)
 是一种有特殊性质的氢化物。
是一种有特殊性质的氢化物。①已知:氢键
 中三原子在一条直线上时,作用力最强。测定结果表明,
中三原子在一条直线上时,作用力最强。测定结果表明,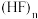 固体中
固体中 分子排列成锯齿形。画出含2个
分子排列成锯齿形。画出含2个 的重复单元结构:
的重复单元结构:②
 中加入
中加入 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:(4)工业上用蒬石(主要成分
 )制备
)制备 。
。 晶体的一种立方晶胞如图所示。
晶体的一种立方晶胞如图所示。
 晶体中距离
晶体中距离 最近的
最近的 有
有②晶体中
 与
与 的最近距离为
的最近距离为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。该晶体的密度
。该晶体的密度
 (列出计算式)。
(列出计算式)。
您最近半年使用:0次
解题方法
2 . 钛酸钡粉体是电子陶瓷元器件的母体材料,广泛应用于多个领域。以BaCl2溶液、TiCl4溶液、H2C2O4溶液为原料制备前驱体草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],再经高温煅烧制得钛酸钡粉体。
(1)Ti位于元素周期表中的___________ 区。
(2)补全制备前驱体草酸氧钛钡晶体的化学反应方程式。___________ 。
BaCl2+TiCl4+2H2C2O4+H2O=BaTiO(C2O4)2·4H2O↓+___________
(3)煅烧过程中有无水草酸氧钛钡晶体生成,其结构如图所示。
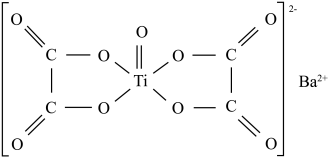
① 中的C原子采取
中的C原子采取___________ 杂化轨道成键。
②理论研究表明: 中四个碳氧键完全相同,
中四个碳氧键完全相同, 所有原子共面的平面型结构[图(a)]不如非平面型结构(每个C原子与临近的3个原子形成的平面相互垂直)[图(b)]稳定。非平面型结构更稳定的原因是
所有原子共面的平面型结构[图(a)]不如非平面型结构(每个C原子与临近的3个原子形成的平面相互垂直)[图(b)]稳定。非平面型结构更稳定的原因是___________ 。

③H2C2O4的Ka1大于CH3COOH的Ka,从结构角度解释原因___________ 。
(4)立方钛酸钡晶体的结构如图所示。
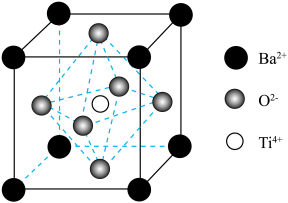
①O2-周围与它最近且距离相等的O2-有___________ 个。
②该晶体晶胞的边长为anm,晶体密度为___________ g·cm-3。(列出计算式,已知阿伏伽德罗常数为NA,1nm=10-7cm)
(1)Ti位于元素周期表中的
(2)补全制备前驱体草酸氧钛钡晶体的化学反应方程式。
BaCl2+TiCl4+2H2C2O4+H2O=BaTiO(C2O4)2·4H2O↓+___________
(3)煅烧过程中有无水草酸氧钛钡晶体生成,其结构如图所示。

①
 中的C原子采取
中的C原子采取②理论研究表明:
 中四个碳氧键完全相同,
中四个碳氧键完全相同, 所有原子共面的平面型结构[图(a)]不如非平面型结构(每个C原子与临近的3个原子形成的平面相互垂直)[图(b)]稳定。非平面型结构更稳定的原因是
所有原子共面的平面型结构[图(a)]不如非平面型结构(每个C原子与临近的3个原子形成的平面相互垂直)[图(b)]稳定。非平面型结构更稳定的原因是
③H2C2O4的Ka1大于CH3COOH的Ka,从结构角度解释原因
(4)立方钛酸钡晶体的结构如图所示。

①O2-周围与它最近且距离相等的O2-有
②该晶体晶胞的边长为anm,晶体密度为
您最近半年使用:0次
名校
解题方法
3 . (一)我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为___________ ;单晶硅的晶体类型为___________ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。
(2)CO2分子中存在___________ 个 键和
键和___________ 个 键。
键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是___________ 。
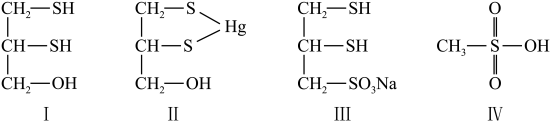
(二)很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。___________ 。
(5)H2S、CH4、H2O的沸点由高到低顺序为___________ 。
(6)汞的原子序数为80,位于元素周期表第___________ 周期第ⅡB族。
(7)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有___________ 。
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(8)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是___________ 。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排式为
(2)CO2分子中存在
 键和
键和 键。
键。(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(二)很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
(5)H2S、CH4、H2O的沸点由高到低顺序为
(6)汞的原子序数为80,位于元素周期表第
(7)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(8)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是
您最近半年使用:0次
名校
解题方法
4 . 下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,回答下列问题:
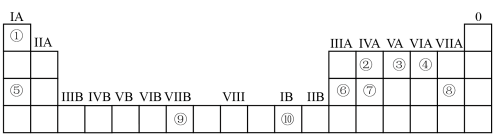
(1)①、②、③、④的电负性由大到小的顺序是__________________ (用元素符号表示).
(2)量子力学把电子在原子核外的一个空间运动状态 称为一个原子轨道,基态③原子的电子有______ 种空间运动状态 .
(3)④、⑤、⑥的原子半径由大到小的顺序为__________________ (用元素符号表示).
(4)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是__________________ (用化学式表示).
(5)①、④、⑤、⑧中的某些 元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________________________ .
(6)第一电离能( ):
):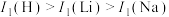 ,原因是
,原因是________________________ .
(7)铁元素在元素周期表中的位置________________________ ,基态 的价层电子排布式为
的价层电子排布式为________________________ .
(8)基态⑧原子占据的最高能级的电子云轮廓图的形状是______ 形;基态⑨原子的价层电子排布的轨道表示式为________________________ ;元素⑩属于______ 区(填“s”、“d”、“ds”或“p”).
(9)由④元素形成的常见物质有很多,例如: 、
、 、
、 等.基态④原子的核外电子排布式是
等.基态④原子的核外电子排布式是______ ,对 分子结构的研究,曾有以下推测:
分子结构的研究,曾有以下推测:
根据测定 分子中
分子中______ (填字母序号),确定其结构一定不是甲.
a.H—O键长 b.O—O键能 c.H—O—O键角

(1)①、②、③、④的电负性由大到小的顺序是
(2)量子力学把电子在原子核外的一个
(3)④、⑤、⑥的原子半径由大到小的顺序为
(4)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(5)①、④、⑤、⑧中的
(6)第一电离能(
 ):
):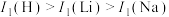 ,原因是
,原因是(7)铁元素在元素周期表中的位置
 的价层电子排布式为
的价层电子排布式为(8)基态⑧原子占据的最高能级的电子云轮廓图的形状是
(9)由④元素形成的常见物质有很多,例如:
 、
、 、
、 等.基态④原子的核外电子排布式是
等.基态④原子的核外电子排布式是 分子结构的研究,曾有以下推测:
分子结构的研究,曾有以下推测:
根据测定
 分子中
分子中a.H—O键长 b.O—O键能 c.H—O—O键角
您最近半年使用:0次
名校
5 . 工业中可利用生产钛白的副产物 和硫铁矿(
和硫铁矿( )联合制备铁精粉(
)联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。
)和硫酸,实现能源及资源的有效利用。
(1) 结构示意图如图。
结构示意图如图。

①基态O原子的核外电子轨道表示式___________ 。
② 的价层电子排布式为
的价层电子排布式为___________ 。
③与O和S同主族的Se元素基态原子的简化电子排布式为___________ 。
(2)O与同周期的C、N三种元素的第一电离能由小到大的顺序是___________ 。
(3) 中含有
中含有 和
和 两种粒子。
两种粒子。
① 分子的空间结构为
分子的空间结构为___________ 。
② 中O和
中O和 中S均为
中S均为___________ 杂化,已知 中H-O-H键角小于
中H-O-H键角小于 中O-S-O键角,请解释原因
中O-S-O键角,请解释原因___________ 。
(4) 加热脱水后生成
加热脱水后生成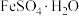 ,再与
,再与 在氧气中掺烧可联合制备铁精粉和硫酸。
在氧气中掺烧可联合制备铁精粉和硫酸。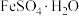 分解和
分解和 在氧气中燃烧的能量示意图如图,利用
在氧气中燃烧的能量示意图如图,利用 作为
作为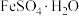 分解的燃料,除反应产物是铁精粉和制硫酸的原料外,从能源利用的角度说明该工艺的优点
分解的燃料,除反应产物是铁精粉和制硫酸的原料外,从能源利用的角度说明该工艺的优点___________ 。

 和硫铁矿(
和硫铁矿( )联合制备铁精粉(
)联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。
)和硫酸,实现能源及资源的有效利用。(1)
 结构示意图如图。
结构示意图如图。
①基态O原子的核外电子轨道表示式
②
 的价层电子排布式为
的价层电子排布式为③与O和S同主族的Se元素基态原子的简化电子排布式为
(2)O与同周期的C、N三种元素的第一电离能由小到大的顺序是
(3)
 中含有
中含有 和
和 两种粒子。
两种粒子。①
 分子的空间结构为
分子的空间结构为②
 中O和
中O和 中S均为
中S均为 中H-O-H键角小于
中H-O-H键角小于 中O-S-O键角,请解释原因
中O-S-O键角,请解释原因(4)
 加热脱水后生成
加热脱水后生成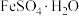 ,再与
,再与 在氧气中掺烧可联合制备铁精粉和硫酸。
在氧气中掺烧可联合制备铁精粉和硫酸。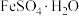 分解和
分解和 在氧气中燃烧的能量示意图如图,利用
在氧气中燃烧的能量示意图如图,利用 作为
作为 分解的燃料,除反应产物是铁精粉和制硫酸的原料外,从能源利用的角度说明该工艺的优点
分解的燃料,除反应产物是铁精粉和制硫酸的原料外,从能源利用的角度说明该工艺的优点
您最近半年使用:0次
名校
解题方法
6 . 甲硅烷 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。
(1) 原子与
原子与 原子结合时,
原子结合时, 表现为正价,则电负性:
表现为正价,则电负性:
___________ H(填“>”“<”或“=”), 分子的空间结构为
分子的空间结构为___________ 。
(2)利用 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。

①碳化硅晶体中每个 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为________ , 的晶体类型是
的晶体类型是_______ 。
②基态 原子的价层电子轨道表达式为
原子的价层电子轨道表达式为___________ 。
(3)利用 与
与 可制得氮化硅(
可制得氮化硅( )材料。
)材料。
①热稳定性:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
② 中
中 的键角
的键角___________  中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是___________ 。
 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。(1)
 原子与
原子与 原子结合时,
原子结合时, 表现为正价,则电负性:
表现为正价,则电负性:
 分子的空间结构为
分子的空间结构为(2)利用
 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
①碳化硅晶体中每个
 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为 的晶体类型是
的晶体类型是②基态
 原子的价层电子轨道表达式为
原子的价层电子轨道表达式为(3)利用
 与
与 可制得氮化硅(
可制得氮化硅( )材料。
)材料。①热稳定性:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②
 中
中 的键角
的键角 中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是
您最近半年使用:0次
名校
解题方法
7 . 我国科学家发现催化剂 可高效活化
可高效活化 ,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意图如下。
,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意图如下。
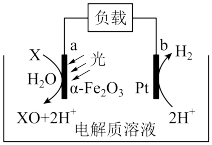
(1)基态Fe原子的价层电子排布式是___________ 。
(2)污染物X在电极a上的反应式是___________ 。
(3)科研团队研究了X分别为 、
、 和
和 [也可以写作
[也可以写作 ]的反应能力,发现中心原子含有孤电子对的物质易被氧化。
]的反应能力,发现中心原子含有孤电子对的物质易被氧化。
①O、P、As的电负性由小到大的顺序是___________ (用元素符号表示)。
② 中的键角
中的键角___________ (填“>”“<”或“=”) 中的键角。
中的键角。
③ 的结构是
的结构是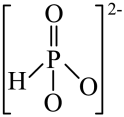 ,P原子的杂化轨道类型是
,P原子的杂化轨道类型是___________ 。
④比较反应能力:
___________  (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是___________ 。
(4) 晶胞的体积为
晶胞的体积为 ,晶体密度为
,晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,一个晶胞中Fe原子的个数为
,一个晶胞中Fe原子的个数为___________ ( 的摩尔质量:160g/mol)。
的摩尔质量:160g/mol)。
 可高效活化
可高效活化 ,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意图如下。
,实现物质的高选择性氧化,为污染物的去除提供了新策略。污染物X去除的催化反应过程示意图如下。
(1)基态Fe原子的价层电子排布式是
(2)污染物X在电极a上的反应式是
(3)科研团队研究了X分别为
 、
、 和
和 [也可以写作
[也可以写作 ]的反应能力,发现中心原子含有孤电子对的物质易被氧化。
]的反应能力,发现中心原子含有孤电子对的物质易被氧化。①O、P、As的电负性由小到大的顺序是
②
 中的键角
中的键角 中的键角。
中的键角。③
 的结构是
的结构是 ,P原子的杂化轨道类型是
,P原子的杂化轨道类型是④比较反应能力:

 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是(4)
 晶胞的体积为
晶胞的体积为 ,晶体密度为
,晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,一个晶胞中Fe原子的个数为
,一个晶胞中Fe原子的个数为 的摩尔质量:160g/mol)。
的摩尔质量:160g/mol)。
您最近半年使用:0次
名校
解题方法
8 . 硅烷广泛应用在现代高科技领域。制备硅烷的反应为:SiF4+NaAlH4=SiH4+NaAlF4.
(1)①基态硅原子的价层电子轨道表示式为_____ ,基态硅原子的电子有_____ 种空间运动状态。
②SiF4中,硅的化合价为+4价。硅显正化合价的原因是_____ 。
③下列说法正确的是_____ (填字母)。
a.SiH4的稳定性比CH4的差
b.SiH4中4个Si-H的键长相同,H-Si-H的键角为90°
c.SiH4中硅原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个Si-Hσ键
④SiF4的沸点(-86℃)高于SiH4的沸点(-112℃),原因是_____ 。
⑤键角:SiF4_____ SiH4,原因_____ 。
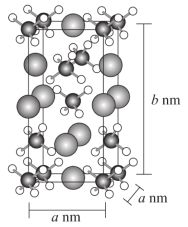
(2)NaAlH4的晶胞结构如图所示,晶胞的体积为a2b×10-21cm3。
①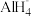 的VSEPR模型名称为
的VSEPR模型名称为_____ 。
②用NA表示阿伏加德罗常数的值。NaAlH4晶体密度为_____ g•cm-3(用含a、b、NA的代数式表示)。
③NaAlH4是一种具有应用潜能的储氢材料,其释氢过程可用化学方程式表示为:3NaAlH4═Na3AlH6+2Al+3H2↑。掺杂22Ti替换晶体中部分Al,更利于NaAlH4中H的解离,使体系更容易释放氢。从结构的角度推测其可能的原因:_____ 。
(1)①基态硅原子的价层电子轨道表示式为
②SiF4中,硅的化合价为+4价。硅显正化合价的原因是
③下列说法正确的是
a.SiH4的稳定性比CH4的差
b.SiH4中4个Si-H的键长相同,H-Si-H的键角为90°
c.SiH4中硅原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个Si-Hσ键
④SiF4的沸点(-86℃)高于SiH4的沸点(-112℃),原因是
⑤键角:SiF4
(2)NaAlH4的晶胞结构如图所示,晶胞的体积为a2b×10-21cm3。

①
 的VSEPR模型名称为
的VSEPR模型名称为②用NA表示阿伏加德罗常数的值。NaAlH4晶体密度为
③NaAlH4是一种具有应用潜能的储氢材料,其释氢过程可用化学方程式表示为:3NaAlH4═Na3AlH6+2Al+3H2↑。掺杂22Ti替换晶体中部分Al,更利于NaAlH4中H的解离,使体系更容易释放氢。从结构的角度推测其可能的原因:
您最近半年使用:0次
名校
解题方法
9 . 甲硅烷 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。
(1)Si原子与H原子结合时,Si表现为正价,则电负性:Si___________ H(填“>”“<”或“=”), 分子的空间结构名称为
分子的空间结构名称为___________ 。
(2)利用 与
与 可制得氮化硅(
可制得氮化硅( )材料。
)材料。 中
中 的键角
的键角___________  中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是___________ 。
(3)利用 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。

①热稳定性:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②碳化硅晶体中每个Si原子周围距离最近的C原子数目为___________ ,SiC的晶体类型是___________ 。
③已知碳化硅的晶胞边长为a nm(1 m),阿伏伽德罗常数为
m),阿伏伽德罗常数为 。则碳化硅晶体的密度为
。则碳化硅晶体的密度为___________ g⋅cm-3(列出计算式)。
④硅、金刚石和碳化硅晶体的熔点从高到低依次是___________ 。
(4)硅元素最高价氧化物对应的水化物为原硅酸( )。
)。
资料:原硅酸( )可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
)可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
①原硅酸钠( )溶液吸收空气中的
)溶液吸收空气中的 会生成
会生成 ,结合元素周期律解释原因:
,结合元素周期律解释原因:___________ 。
②从结构的角度解释 脱水后溶解度降低的原因:
脱水后溶解度降低的原因:___________ 。
 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。(1)Si原子与H原子结合时,Si表现为正价,则电负性:Si
 分子的空间结构名称为
分子的空间结构名称为(2)利用
 与
与 可制得氮化硅(
可制得氮化硅( )材料。
)材料。 中
中 的键角
的键角 中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是(3)利用
 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
①热稳定性:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②碳化硅晶体中每个Si原子周围距离最近的C原子数目为
③已知碳化硅的晶胞边长为a nm(1
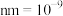 m),阿伏伽德罗常数为
m),阿伏伽德罗常数为 。则碳化硅晶体的密度为
。则碳化硅晶体的密度为④硅、金刚石和碳化硅晶体的熔点从高到低依次是
(4)硅元素最高价氧化物对应的水化物为原硅酸(
 )。
)。资料:原硅酸(
 )可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
)可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。①原硅酸钠(
 )溶液吸收空气中的
)溶液吸收空气中的 会生成
会生成 ,结合元素周期律解释原因:
,结合元素周期律解释原因:②从结构的角度解释
 脱水后溶解度降低的原因:
脱水后溶解度降低的原因:
您最近半年使用:0次
解题方法
10 . 异氰酸苯酯( )是重要的农药中间体,广泛用于合成杀菌剂、除草剂、植物生长调节剂等制备异氰酸苯酯最常用、最经济的原料是苯胺与光气反应,其反应过程如图:
)是重要的农药中间体,广泛用于合成杀菌剂、除草剂、植物生长调节剂等制备异氰酸苯酯最常用、最经济的原料是苯胺与光气反应,其反应过程如图:
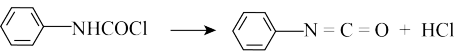
(1)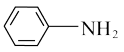 中的官能团是
中的官能团是_____ (写结构简式)。
(2)①光气(COCl2)的结构式为_____ 。
②氯元素基态原子的电子排布式为_____ 。
(3)氯吡苯脲是经国家批准使用的植物生长膨大剂之一、其结构简式为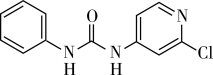 。
。
资料:异氛酸苯酯与2-氯-4-氨基吡啶反应,可生成氯吡苯脲,其反应方程式如下:
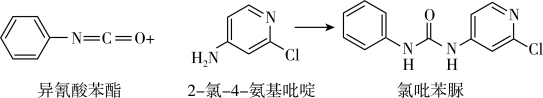 。
。
回答下列问题:
①该反应的反应类型为_____ 。
②反应过程中,每生成1个氯吡苯脲,断裂_____ 个σ键,断裂_____ 个π键。
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有NH3、CO2、H2O等。
①CO2、NH3的空间结构分别是_____ 、_____ 。
②请用共价键知识解释H2O分子比NH3分子稳定的原因_____ 。
 )是重要的农药中间体,广泛用于合成杀菌剂、除草剂、植物生长调节剂等制备异氰酸苯酯最常用、最经济的原料是苯胺与光气反应,其反应过程如图:
)是重要的农药中间体,广泛用于合成杀菌剂、除草剂、植物生长调节剂等制备异氰酸苯酯最常用、最经济的原料是苯胺与光气反应,其反应过程如图:
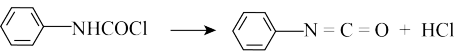
(1)
 中的官能团是
中的官能团是(2)①光气(COCl2)的结构式为
②氯元素基态原子的电子排布式为
(3)氯吡苯脲是经国家批准使用的植物生长膨大剂之一、其结构简式为
 。
。资料:异氛酸苯酯与2-氯-4-氨基吡啶反应,可生成氯吡苯脲,其反应方程式如下:
 。
。回答下列问题:
①该反应的反应类型为
②反应过程中,每生成1个氯吡苯脲,断裂
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有NH3、CO2、H2O等。
①CO2、NH3的空间结构分别是
②请用共价键知识解释H2O分子比NH3分子稳定的原因
您最近半年使用:0次



